李毓龙组及其合作者在《Nature Biotechnology》报道新型乙酰胆碱荧光探针的开发及其应用
2018年7月9日,北京大学生命科学学院、北大-清华生命科学联合中心、PKU-IDG/麦戈文脑科学研究所李毓龙研究组及其合作者,在《Nature Biotechnology》杂志在线发表了题为《A genetically encoded fluorescent acetylcholine indicator for in vitro and in vivo studies》的研究论文,首次成功开发了灵敏、特异、可遗传编码的乙酰胆碱荧光探针,并成功地在不同生物体系中实时检测内源乙酰胆碱信号,为理解乙酰胆碱在生理和病理条件下的功能提供了重要的工具。
乙酰胆碱是研究史上第一个被鉴定的神经递质,其相关研究推动了神经递质和突触传递的概念的建立1-4。目前人们已经对乙酰胆碱能神经元在外周神经系统(尤其是神经肌肉接点)的功能有了较为明确的阐述,但对其在中枢神经系统中的结构和功能的认识仍存在较大争议5。由于乙酰胆碱能神经元在皮层等区域的广泛投射,传统研究认为乙酰胆碱在大脑中作为广谱的神经调质,在多个脑区起到均一化的作用,如调节觉醒等生理功能6, 7。然而,随着近年来神经环路研究的推动,乙酰胆碱能神经元参与的神经环路与学习记忆、注意、奖赏等行为的相关性被逐渐解析,并且其功能多呈现区域特异性甚至神经元特异性的功能调节8-10。与此相对,在多种复杂神经疾病如成瘾、阿兹海默症中都伴随着特定脑区胆碱能信息传递的异常11-13。子曰:“工欲善其事,必先利其器”。进一步的了解乙酰胆碱的生理功能及其在疾病中的贡献需要合适的方法,能够细胞特异性且实时灵敏的对乙酰胆碱在特定行为中的动态变化进行追踪。
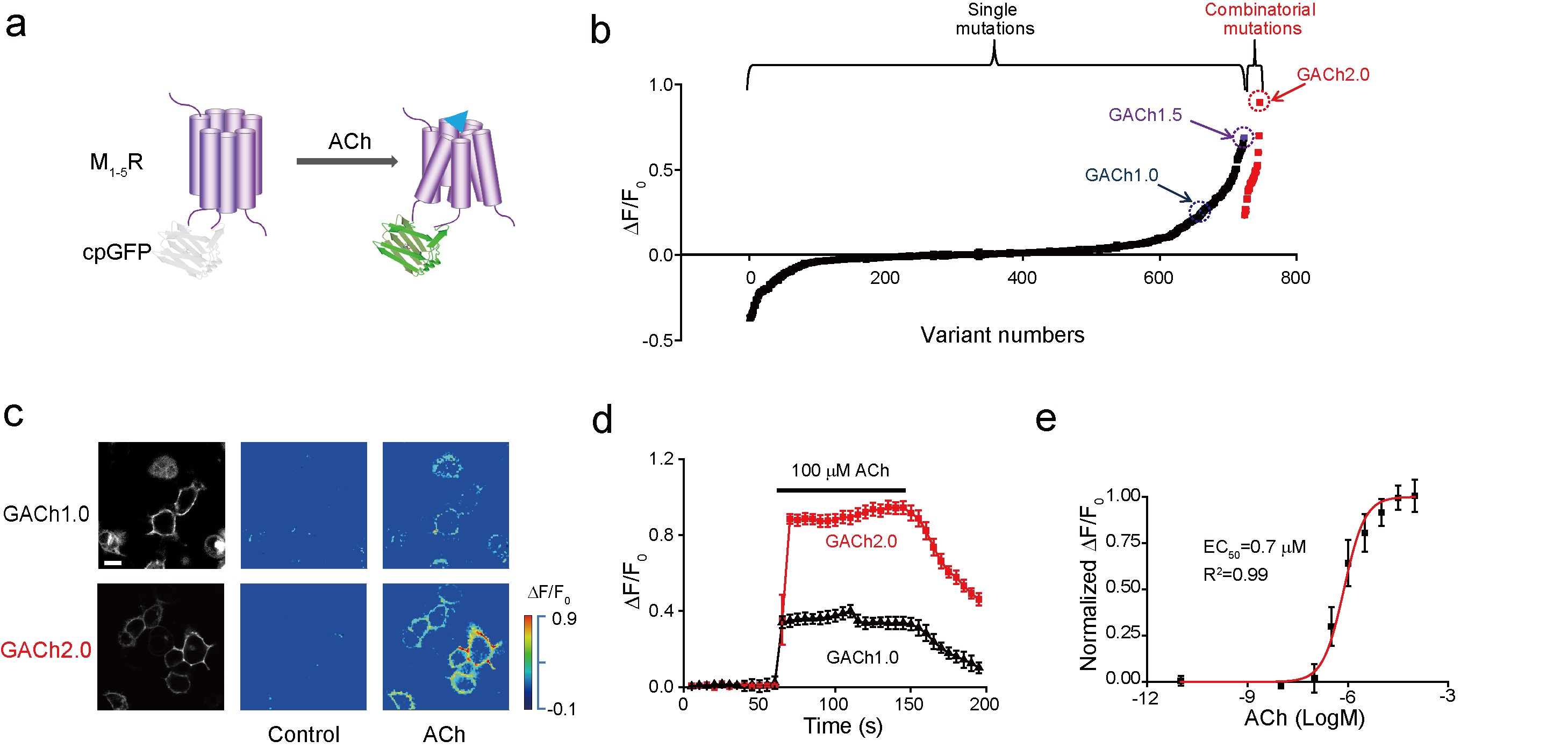
与其从头设计,不如借鉴大自然的鬼斧神工。该研究首次通过对于神经递质特异的G蛋白偶联受体(GPCR)进行改造,通过在特定位置嵌入循环重排的荧光蛋白14,将受体在被神经递质激活后的构象变化转变为荧光蛋白荧光信号的变化,进而反映对应神经递质的浓度变化。通过对于乙酰胆碱受体的改造以及一系列突变筛选和优化,该研究获得对于乙酰胆碱具有灵敏光学响应的荧光探针,其对于生理浓度乙酰胆碱具有高信噪比的光学信号变化,并且具有亚秒级的反应速度以及良好的分子特异性,可实现时空特异的对于乙酰胆碱信号的精确指征。
1. Dale, H.H., Feldberg, W. & Vogt, M. Release of acetylcholine at voluntary motor nerve endings. The Journal of Physiology 86, 353-380 (1936).
2. Loewi, O. Weiteres ber Humorale bertragbarkeit der Herznervenwirkung. Klinische Wochenschrift 3, 680-681 (1924).
3. Katz, B. & Miledi, R., Vol. 207 1097-1098 (1965).
4. Katz, B. & Miledi, R. the Effect of Calcium on Acetylcholine Release From Motor Nerve Terminals. Proceedings of the Royal Society of London. Series B, Containing papers of a Biological character. Royal Society (Great Britain) 161, 496-503 (1965).
5. Sarter, M., Parikh, V. & Howe, W.M. Phasic acetylcholine release and the volume transmission hypothesis: time to move on. Nat Rev Neurosci 10, 383-390 (2009).
6. Hasselmo, M.E. Neuromodulation: Acetylcholine and memory consolidation. Trends in Cognitive Sciences 3, 351-359 (1999).
7. Picciotto, M.R., Higley, M.J. & Mineur, Y.S. Acetylcholine as a Neuromodulator: Cholinergic Signaling Shapes Nervous System Function and Behavior. Neuron 76, 116-129 (2012).
8. Klinkenberg, I., Sambeth, A. & Blokland, A., Vol. 221 430-442 (2011).
9. Lim, S.A.O., Kang, U.J. & McGehee, D.S. Striatal cholinergic interneuron regulation and circuit effects. Frontiers in Synaptic Neuroscience 6 (2014).
10. Jiang, L. et al. Cholinergic signaling controls conditioned fear behaviors and enhances plasticity of cortical-amygdala circuits. Neuron 90, 1057-1070 (2016).
11. Mash, D.C., Flynn, D.D. & Potter, L.T. Loss of M2 muscarine receptors in the cerebral cortex in Alzheimer's disease and experimental cholinergic denervation. Science 228, 1115-1117 (1985).
12. Dineley, K.T., Pandya, A.A. & Yakel, J.L. Nicotinic ACh receptors as therapeutic targets in CNS disorders. Trends Pharmacol Sci 36, 96-108 (2015).
13. Wesson Ashford, J. Treatment of Alzheimer's disease: the legacy of the cholinergic hypothesis, neuroplasticity, and future directions. J Alzheimers Dis 47, 149-156 (2015).
14. Baird, G.S., Zacharias, D.a. & Tsien, R.Y. Circular permutation and receptor insertion within green fluorescent proteins. Proceedings of the National Academy of Sciences of the United States of America 96, 11241-11246 (1999).



