Cell Chem Biol |王初课题组与合作者通过定量化学蛋白质组学
揭示CSE蛋白的O-GlcNAc修饰抑制滋养层细胞合体化的机制
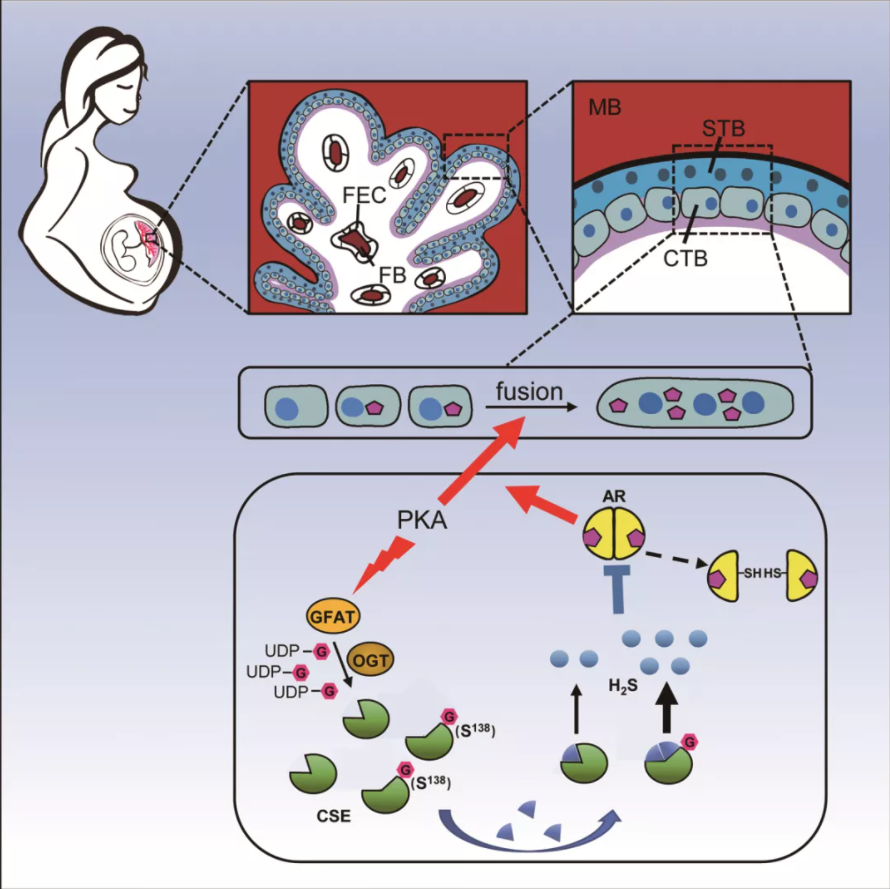
近日,北京大学化学与分子工程学院、生命科学联合中心王初课题组与中国科学院动物研究所王雁玲课题组及北京大学陈兴课题组在Cell Chemical Biology杂志上合作发表了题为“Quantitative Chemoproteomics Reveals O-GlcNAcylation of Cystathionine γ-lyase(CSE) Represses Trophoblast Syncytialization”的研究论文。在这项工作中,三个课题组发挥各自的研究专长,通力合作,利用体外诱导的滋养层细胞系合体化模型,结合O-GlcNAc化学酶法标记技术和定量化学蛋白质组学技术,首次实现对人胎盘滋养层细胞中O-GlcNAc动态修饰的大规模定量分析,从而进一步揭示了CSE蛋白的O-GlcNAc修饰对滋养层细胞合体化的调控作用。

O-GlcNAc修饰是一种在真核细胞中广泛存在且动态发生的翻译后修饰,目前,已经发现了超过2000种O-GlcNAc糖基化修饰蛋白,这些蛋白广泛参与到多种细胞过程中,如增殖,分化,凋亡等。O-GlcNAc修饰的失衡会导致多种妊娠和胎盘相关疾病的发生,例如母体O-GlcNAc修饰水平的紊乱会损害胚胎着床前囊胚的形成;小鼠胎盘中OGT基因的敲除会发生严重的产前应激等。虽然O-GlcNAc修饰对胎盘的发育及妊娠的维持至关重要,但目前O-GlcNAc修饰对胎盘发育调控的分子机制仍知之甚少,这很大程度上是由于缺乏挖掘胎盘中关键O-GlcNAc底物蛋白的研究方法。王初课题组和陈兴课题组近年来基于O-GlcNAc代谢标记技术和化学酶法标记技术,合作发展了一系列定量化学蛋白质组学方法用于研究O-GlcNAc修饰的动态变化[1-4]。在本文中,他们与动物所王雁玲课题组合作将基于化学酶法标记的O-GlcNAc定量蛋白质组学技术首次应用于鉴定胎盘滋养层细胞合体化过程中的关键的O-GlcNAc修饰调控蛋白。
作者首先利用体外forskolin(FSK,一种PKA信号激活剂)诱导BeWo细胞(一种人的滋养层细胞系)的合体化模型,结合基于GalT的O-GlcNAc化学酶法标记和还原二甲基化定量蛋白质组学技术,建立了第一个人胎盘滋养层细胞O-GlcNAc修饰蛋白数据库。在鉴定到的829个高置信度的O-GlcNAc修饰蛋白中,已确定的O-GlcNAc修饰蛋白占55.7%,新发现的O-GlcNAc修饰蛋白占44.7%。在这些蛋白中,CSE蛋白作为O-GlcNAc修饰水平升高最为显著的蛋白引起了作者极大的关注。
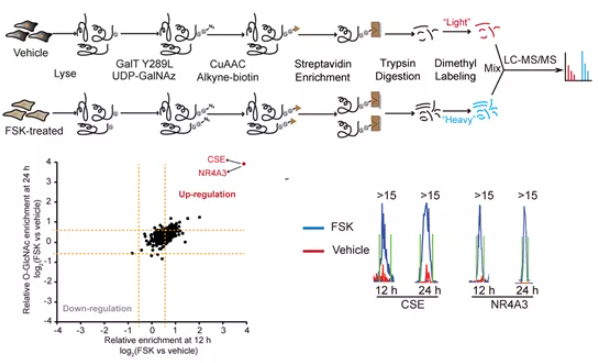
胱硫醚-γ-裂解酶(CSE)是哺乳动物生成H2S的主要催化酶,有研究表明CSE与H2S参与了胎盘功能的调控及妊娠的维持。所以,接下来作者通过一系列生化实验进一步证实了PKA信号能够快速诱导CSE蛋白发生O-GlcNAc修饰。更为重要的是,利用基于ETD碎裂的质谱分析,作者发现CSE的O-GlcNAc修饰位点是第138位的丝氨酸,而该位点在哺乳动物中相当保守。非常有意思的是,随FSK处理时间的延长,CSE蛋白的O-GlcNAc修饰水平及H2S的产量逐渐升高。

为了探究CSE蛋白的O-GlcNAc修饰对滋养层细胞的合体化存在怎样的影响,作者通过过表达野生型CSE蛋白或S138A突变体来检测其对细胞合体化水平的影响,即Syncytin-2与β-hCG的表达水平。作者发现,过表达野生型蛋白可以显著抑制滋养层细胞合体化,而转染突变蛋白则促进合体化,并且该条件下催化生成的H2S与上述趋势相反。这些结果表明CSE的O-GlcNAc修饰生成的H2S显著抑制了滋养层细胞的合体化。接下来,作者还证明生成的H2S可以通过阻碍雄激素受体(AR)的二聚化来实现阻碍睾酮所促进的滋养层细胞的合体化。

作者最后在早发重度子痫前期患者的胎盘(E-PE)中检测发现CSE蛋白的O-GlcNAc修饰水平及H2S的产量显著升高,但滋养层细胞合体化水平显著降低。这些数据表明PE胎盘中异常增高的CSE 蛋白O-GlcNAc修饰可能参与了滋养层细胞的分化障碍。

总之, 本工作结合O-GlcNAc化学酶法标记和还原二甲基化的定量蛋白质组学技术,首次建立了人胎盘滋养层细胞中O-GlcNAc修饰蛋白数据库,并发现CSE第138位丝氨酸被O-GlcNAc修饰。该位点的O-GlcNAc修饰可以显著升高 H2S的产量,生成的H2S又可以通过抑制雄激素受体(AR)的二聚化进而阻碍睾酮促进滋养层细胞的合体化。CSE 通过O-GlcNAc修饰控制了适度的滋养层细胞合体化,实现了胎盘滋养层细胞精细调控的目的。该研究可能会为未来胎盘相关的妊娠并发症的治疗策略的发展提供新线索。中国科学院动物研究所王雁玲研究员、北京大学化学与分子工程学院、生命科学联合中心的王初教授和陈兴教授为本论文的共同通讯作者。中国科学院大学2017级博士生刘娟、中国科学院动物研究所邵璇助理研究员、生命科学联合中心2014级博士毕业生秦为和2016级博士研究生张艳玲为本文的共同第一作者。该工作受到科技部重点研发计划蛋白质专项、基金委创新群体、重大项目和重大研究计划培育项目、生命科学联合中心等项目经费的支持。
本文作者:LJ
本文链接:https://doi.org/10.1016/j.chembiol.2021.01.024
文章DOI:10.1016/j.chembiol.2021.01.24
参考文献:
[1] Qin W, et. al., Quantitative time-resolvedchemoproteomics reveals that stable O-GlcNAc regulates box C/D snoRNPbiogenesis. Proc. Natl. Acad. Sci. U. S. A. 2017, 114(33).
[2] Qin W, et. al., Artificial CysteineS-Glycosylation Induced by Per-O-Acetylated Unnatural Monosaccharides during Metabolic Glycan Labeling. Angew. Chem. Int. Ed. Engl. 2018,57(7).
[3] Qin K, et. al., Quantitative Profiling ofProtein O-GlcNAcylation Sites by an Isotope-Tagged Cleavable Linker. ACS.Chem. Biol. 2018, 13(8).
[4] Qin W, et. al., Chemoproteomic Profiling ofO-GlcNAcylation in Caenorhabditis elegans. Biochemistry. 2020, 59(34).









