Chem. Eur. J. | 王初课题组与董甦伟课题组合作开发基于手性α-氨基酸桥的多肽装订策略
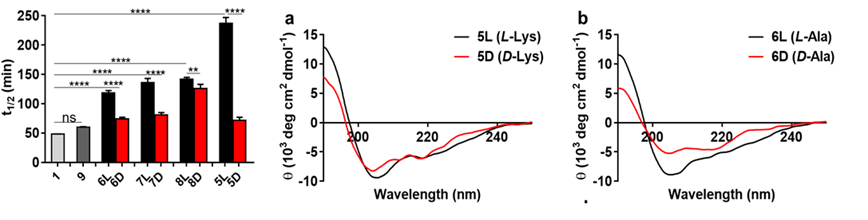
近日,北京大学化学与分子工程学院、生命科学联合中心王初课题组与北京大学药学院董甦伟课题组合作在Chemistry - A European Journal杂志上发表了题为“FineTuning the Properties of Stapled Peptides by Stereogenic α-Amino Acid Bridges”的论文。在这项工作中,作者设计了一种基于手性α-氨基酸桥的新型多肽装订(PeptideStapling)策略,并将之用于稳定化IL-17A抑制肽HAP;对装订肽的动力学模拟揭示了手性连接子对HAP多肽构象的调控机制,最后通过计算设计进一步优化微调了装订肽的生物学特性。
蛋白-蛋白相互作用(PPIs)介导了许多重要的生物学过程,而多肽是靶向这种大而浅的相互作用表面的一种有力工具,短螺旋肽基序亦在许多PPI界面中被发现。
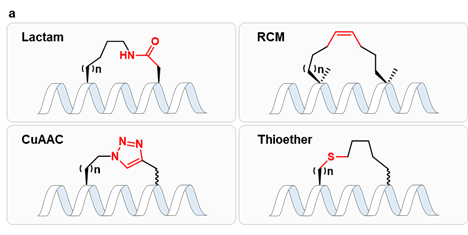
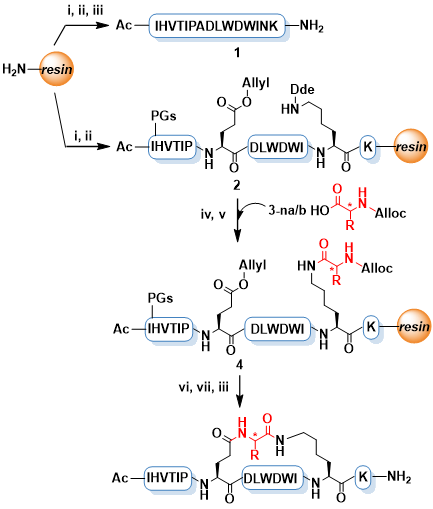
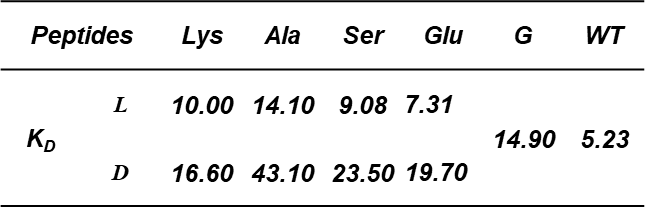
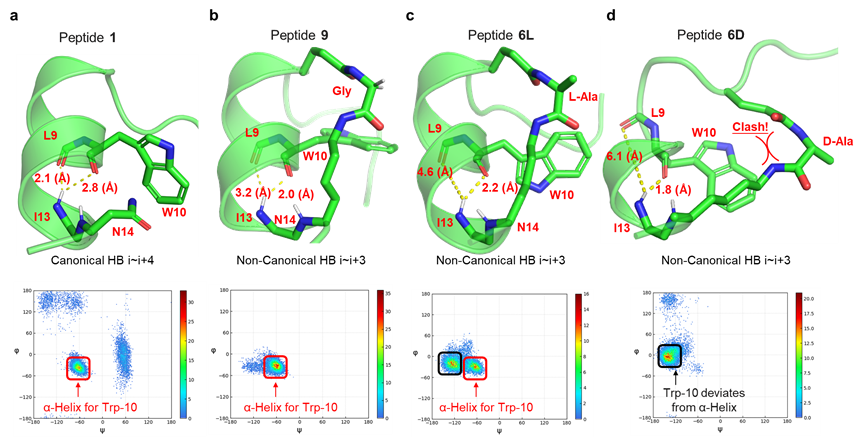
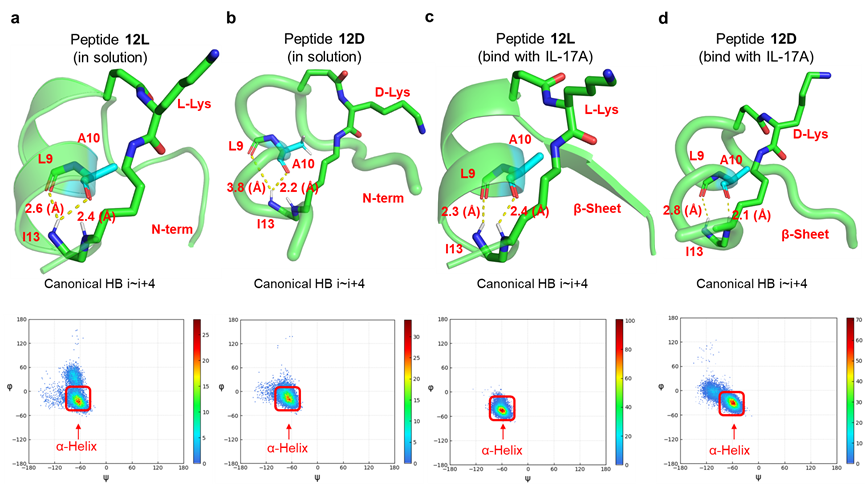
α-氨基酸是一种简单易得的化合物,其自身也是天然或非天然多肽的构建块。本文作者考虑到α-氨基酸具有很好的结构多样性,且天然的α-氨基酸可能相比于上述装订策略具有更好的生物相容性,因此利用α-氨基酸作为连接子构建环肽型骨架可能是一种有吸引力的新型多肽装订策略。作者选择了一条此前报导的IL-17A抑制性螺旋肽 HAP(序列为IHVTIPADLWDWINK,15AAs)作为模型系统,考虑到α-氨基酸作为装订连接子需要形成两个内酰胺键,作者将HAP中的非热点残基Ala7/Asn14分别突变为Glu和Lys,以引入羧基和氨基侧链。随后,通过引入正交的羧基和氨基保护基,作者设计了在树脂上直接得到装订肽的简便合成路线。成功将九种α-氨基酸引入HAP,包括非手性的Gly,以及L/D手性的Ala、Ser、Glu和Lys,涵盖了不同性质的α-氨基酸侧链。
本文的共同通讯作者为北京大学药学院董甦伟教授、北京大学化学与分子工程学院、北大-清华生命科学联合中心的王初教授、以及北京科技大学材料物理与化学系的栾奕副教授。北京大学药学院2018级博士生王椠和北京大学化学与分子工程学院2020级博士生王冯璋为本文的共同第一作者。王初课题组的刘源副研究员为本课题提供了宝贵的指导。该工作得到了国家自然科学基金委的经费支持。
