生命中心戚益军研究组在小非编码
diRNA参与DNA损伤修复的作用机制研究方面取得新进展
2014年3月25日,生命中心戚益军研究组与中科院北京基因组研究所杨运桂研究组在《Cell Research》在线发表题为“Ago2 Facilitates Rad51 Recruitment and DNA Double-Strand Break Repair by Homologous Recombination”的研究论文(论文链接:http://www.cell-research.com/aoparts.asp?id=186)。该论文报道了小非编码RNA (diRNA)及其效应蛋白Ago2,调控DNA同源重组修复重要因子Rad51在DNA双链断裂(double strand break, DSB)位点的招募,从而促进DNA修复的作用机制。
DSB是真核生物基因组后果最严重的损伤,可以导致基因突变、基因组不稳定和细胞死亡,因此与包括癌症在内的多种疾病的发生密切相关。真核细胞已演化出了复杂的DSB修复机制,其涉及到一系列感应蛋白、传导蛋白和效应蛋白的协调作用。戚益军研究组首次报道了真核细胞中存在一类特异性受DSB诱导并在DSB修复中起到重要作用的小RNA,diRNA (DSB-induced small RNA) (Cell 149:101-112,2012;Cell 2012年度最佳论文)。 diRNA如何介导DSB修复尚不清楚。
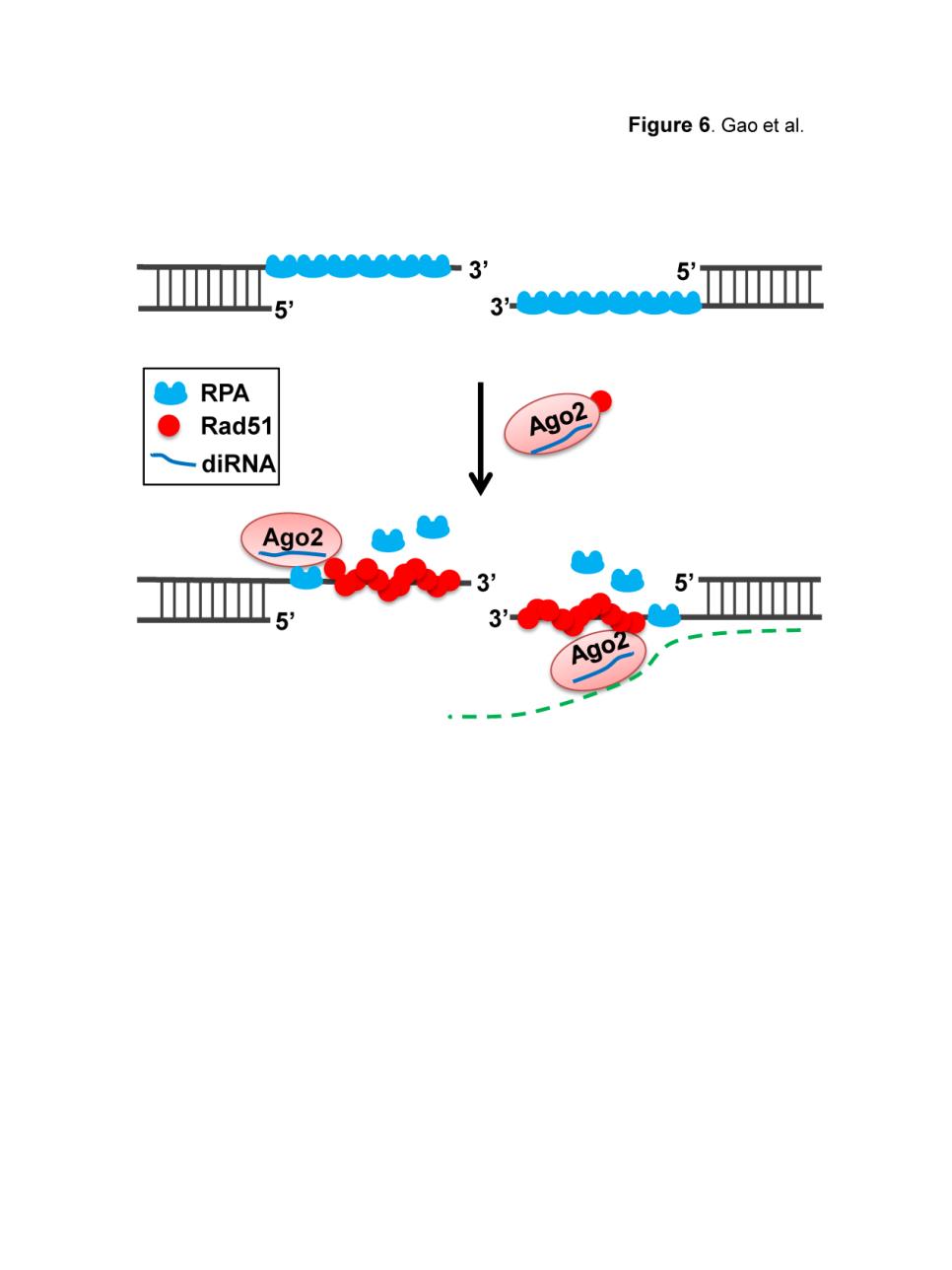
戚益军研究组与杨运桂研究组紧密合作,利用生化和细胞生物学等手段,研究发现diRNA只调控DSB的同源重组修复途径,而不影响非同源末端连接修复途径。这种特异性修复活性依赖于diRNA的效应蛋白Ago2。他们进一步研究发现,Ago2可与同源重组修复重要因子Rad51形成复合物,并且Rad51在DSB位点的招募和同源重组修复活性取决于Ago2的催化活性及其结合小RNA的能力。研究还发现,DSB末端的加工,RPA和Mre11在单链DNA末端的装载不受diRNA和Ago2调控,表明Ago2很可能通过直接调节Rad51的招募发挥作用。这些研究结果表明,Ago2可能在diRNA的指导下,促进Rad51在DNA双链断裂位点的招募或滞留,从而调控同源重组活性,高效修复DNA损伤。
该研究进一步揭示了小RNA在DNA双链断裂修复过程中的保守性和重要功能,为后续从小RNA和DNA修复角度开展对人类疾病如恶性肿瘤发生发展研究提供了新思路。
该研究得到了清华-北大生命科学联合中心、中国科学院、科技部和国家自然科学基金委的资助。