朱卫国研究组取得表观遗传学新成果
生命中朱卫国研究组和东京医科齿科大学合作在新研究中证实:SET7/9介导SUV39H1甲基化,导致了异染色质松散和基因组不稳定。相关论文“Methylation of SUV39H1 by SET7/9 results in heterochromatin relaxation and genome instability”发表在3月18日的《美国科学院院刊》(PNAS)上。
领导这一研究的朱卫国研究组,多年来致力于表观遗传学调控基因表达,肿瘤分子生物学(主要为p53方向)以及细胞自噬的研究,在如Nature等国际主要生物与肿瘤学杂志上发表约50余篇文章。
组蛋白是染色质的核心。尽管对组蛋白甲基化修饰认识已有相当长的时间,但直到最近几年由于组蛋白甲基化修饰酶的发现才使人们逐渐认识到组蛋白甲基化修饰有广泛的生物学功能,像异染色质形成、X 染色体失活、转录调节、干细胞的维持和分化等,此外,组蛋白甲基化修饰的改变与某些人类疾病和肿瘤也有一定关系。
Suv39h1是第一个被发现的特异性H3K9甲基转移酶,可以催化H3K9甲基化。H3K9甲基化是异染色质蛋白(HP1)染色区的停泊位点(docking site),因此组蛋白H3K9甲基化在异染色质形成及基因转录调控中具有重要的作用。近年的一些研究表明,H3K9甲基化失衡与白血病、胃癌等一些癌症发生发展相关。了解Suv39h1酶活性调控机制,有望为癌症的治疗提供新的靶点。
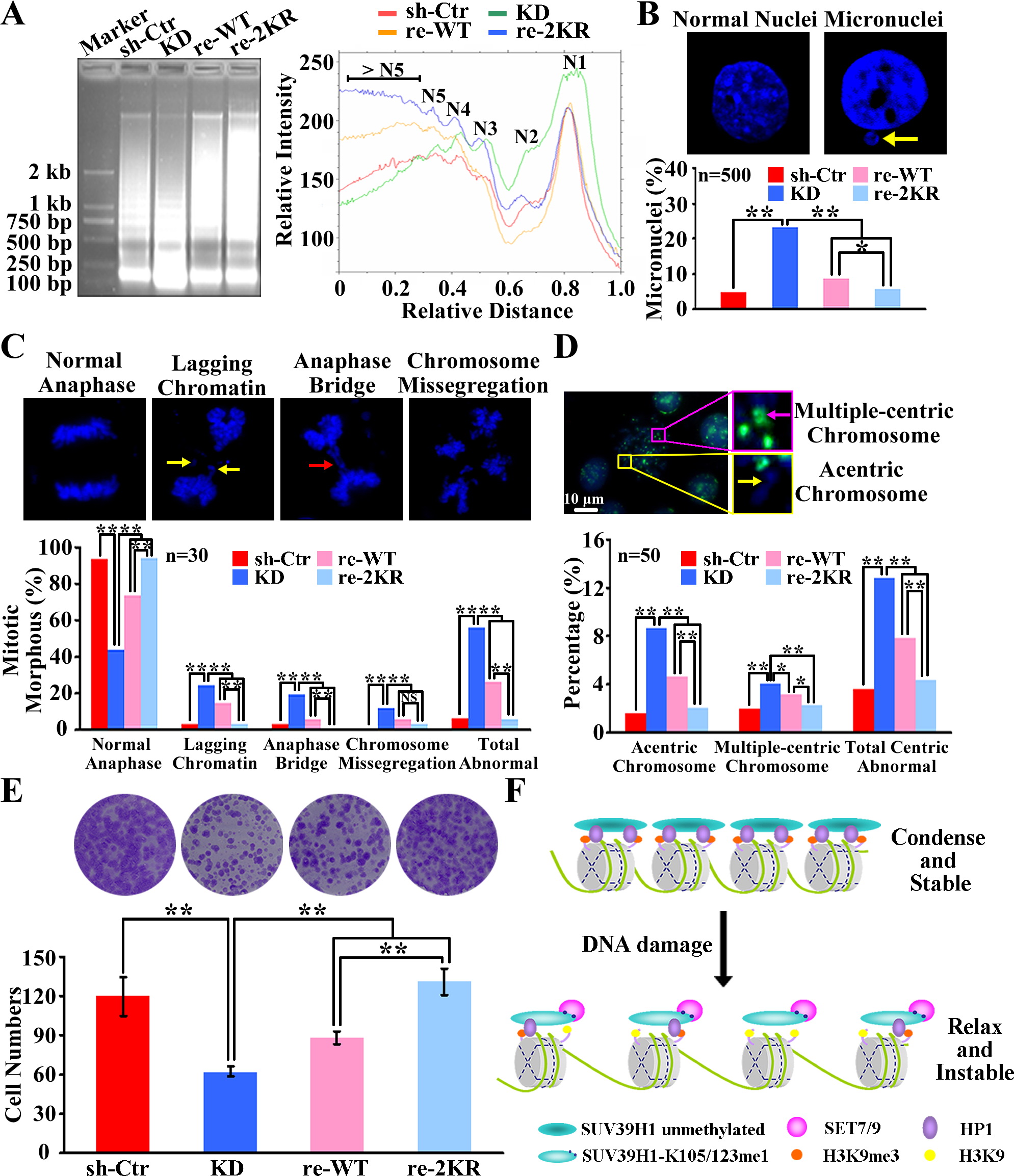
A. 细胞用MNase37度2分钟消化处理,之后提基因组DNA,用1.2%的琼脂糖凝胶分离。每条带用Quantity one扫描分析灰度。N1-N5指每个寡核小体中的核小体数。
B&C. 细胞被固定,DAPI染色。微核或者异常中期染色体分别在间期细胞(n=500)和分裂后期(n=30)细胞中被统计。箭头所示为单个异常体。*P<0 .05;**p<0.01
D. 中期染色体被泛着丝粒探针染色(绿色)。染色体再被DAPI染色(蓝色)。黄色箭头显示无着丝粒染色体,粉色箭头显示多着丝粒染色体。着丝粒的异常被统计分析(n=50). *P<0 .05;**p<0.01
E. 超过500个图中所描述的细胞在6孔板里培养2周,结晶紫染色分析克隆形成。数据结果进行统计学分析。**P<0 .01
F.模式图
在这项研究中,研究人员确定了蛋白质甲基转移酶SET7/9(SET domain-containing protein 7)是SUV39H1活性的一个独特调控因子。当研究人员在体内实验中用一种DNA损伤诱导剂阿霉素(adriamycin)处理时,发现SET7/9与SUV39H1之间存在相互作用。GST pull-down实验证实,SUV39H1含有chromodomain的区域与SET7/9相结合。采用特异性抗甲基化SUV39H1抗体进行Western blot分析,并结合质谱法证实,SET7/9介导了SUV39H1赖氨酸105和123位点特异性甲基化。
尽管甲基化SUV39H1半衰期和定位没有发生显著改变,研究人员发现当SET7/9介导SUV39H1甲基化时,SUV39H1的甲基转移酶活性显著下调。因此异染色质H3K9三甲基化显著减少,转而导致异染色质松弛指示因子satellite 2 (Sat2) 和 α-satellite (α-Sat)表达显著增高。此外,研究人员还利用微球菌核酸酶敏感性测定和免疫荧光检测证实,SUV39H1甲基化可促进基因组失稳定,以及最终的细胞增殖抑制。
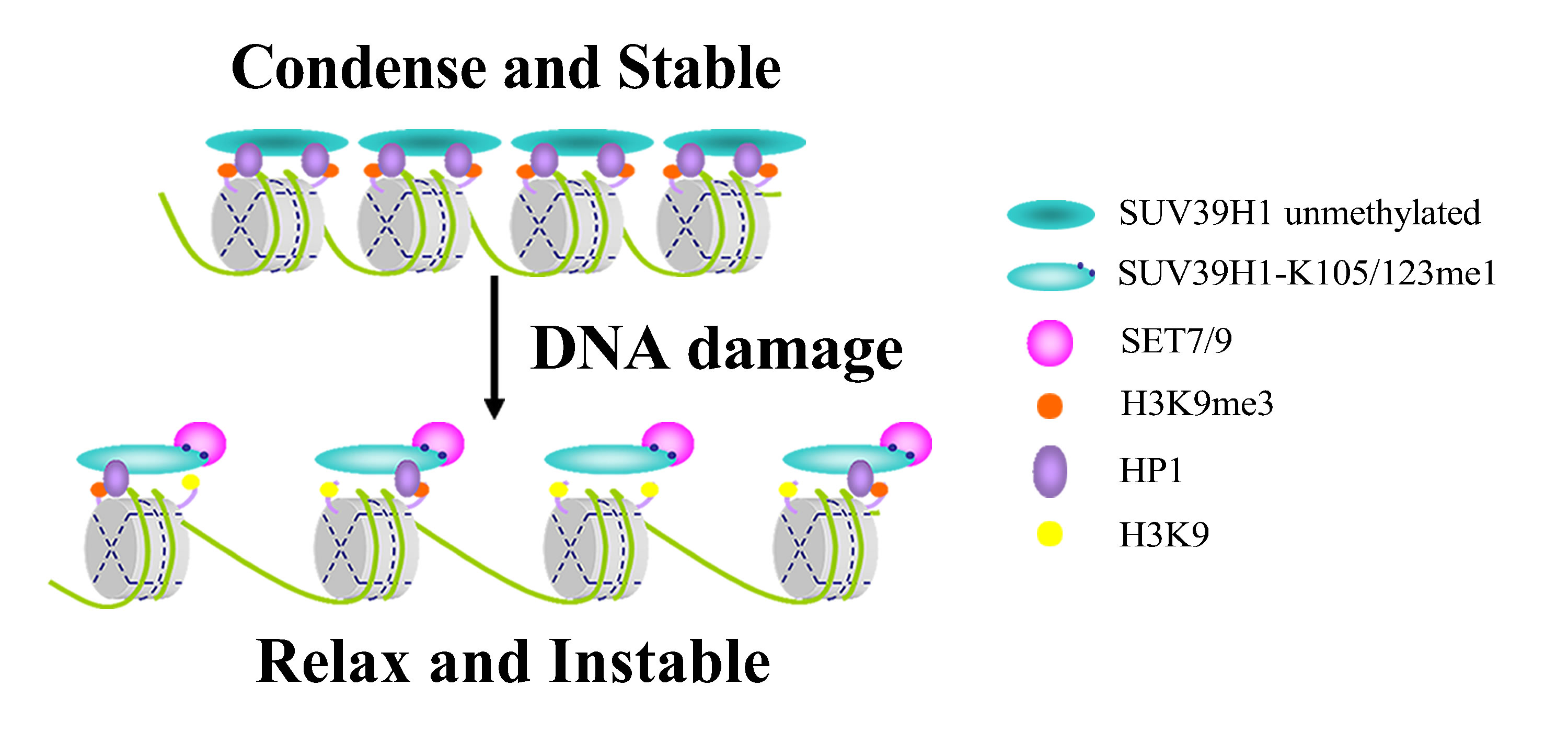
该模式图显示,SET7/9介导的SUV39H1甲基化对异染色质松弛和基因组稳定性的重要作用。DNA损伤时,SET7/9与SUV39H1相互作用并甲基化SUV39H1的赖氨酸105位和123位,影响SUV39H1的甲基化活性,从而使异染色质上H3K9三甲基化水平显著减少,进而使异染色质结构更加松散, 导致基因组不稳定,抑制细胞增值。
这些研究揭示了两种组蛋白甲基转移酶SET7/9和SUV39H1之间的一种独特的相互作用,并证实在癌细胞中这一机制响应DNA损伤诱导了异染色质松弛和基因组不稳定。
