施一公教授研究组在Cell Reports发表研究论文揭示TALE蛋白新功能-- TALE蛋白可以特异识别并保护DNA-RNA杂合双链
2012年9月27日,清华大学生命学院施一公教授研究组,医学院颜宁教授研究组和北京大学席建忠教授合作在细胞子刊《细胞通讯》(Cell Reports)在线发表论文,报道转录激活因子样效应蛋白(TALE)能够特异识别DNA-RNA杂合链,并且能够保护DNA-RNA杂合链不被核酸酶降解,这一发现大大拓展了TALE在生命科学技术领域的应用。
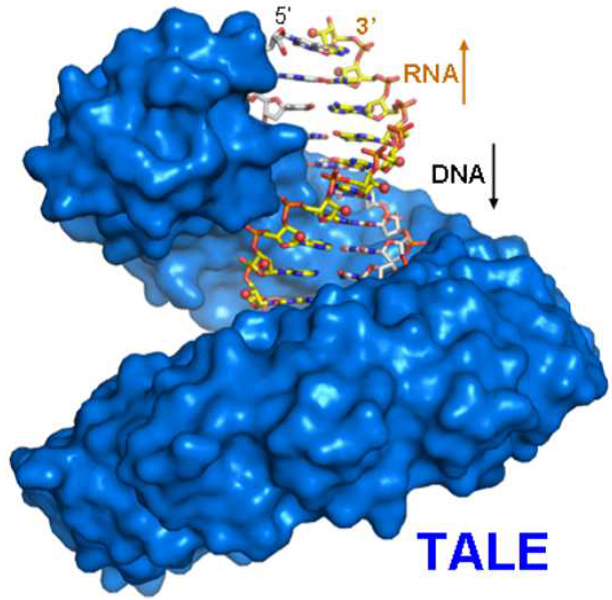
TALE (Transcription Activator Like Effectors)是一类DNA结合蛋白。TALE蛋白的奇特之处在于它的DNA结合结构域是由可变数量的重复单元组成,每一个重复单元特异识别一个DNA碱基对。大多数情况下每个重复单元由34个氨基酸组成。每个重复序列中第13位的氨基酸特异识别DNA正向链中的ATCG碱基。根据TALE蛋白对DNA序列的特异识别,科学家们现在可以设计组装任意的TALE重复单元去识别任意序列的目标双螺旋DNA,并且构造出切割特异双链DNA序列的DNA酶TALEN (TALE nuclease),从而用于在细胞中引入定点突变、定点敲除等操作。在此次研究之前,仅知道TALE蛋白能够识别双螺旋DNA,因此TALE蛋白主要应用在对基因组DNA的操作中。
而在施一公领导的最新研究中,他们检验了TALE蛋白对单链DNA,DNA-RNA杂合链,双链RNA等不同形式核酸链的结合活性,发现TALE蛋白不仅可以识别双链DNA,还能够结合DNA-RNA杂合链,其中DNA是与TALE特异接触的链。他们进一步解析了TALE蛋白结合DNA-RNA杂合链的复合物晶体结构,揭示了TALE蛋白识别DNA-RNA杂合链的分子机理。通过结构分析,他们推测TALE蛋白可以保护DNA-RNA杂合链不被核酸酶RNase H降解,并且利用生化手段验证了这一假设。在这些发现的基础上,他们针对HIV病毒逆转录过程中的一段DNA-RNA杂合序列设计了特异的含有23个重复单元的TALE蛋白TALEHIV,该蛋白有效地阻止了RNase H 对这段DNA-RNA杂合链中RNA链的降解。如果HIV在逆转录过程中,不能有效降解RNA,则不能完成其基因组的扩增。因此,这一发现为抑制HIV病毒提供了新思路。
该论文的共同第一作者是博士后殷平和来自PTN-BBS研究生项目的博士研究生邓东。上海同步辐射(SSRF)为数据收集提供了帮助,保证了该课题的顺利完成。