2024年9月11日,清华大学生命学院、生命中心PI、免疫学研究所、膜生物学全国重点实验室的刘万里教授,与国内多位交叉学科合作者(西湖大学医学院陈相军研究员,华大生命科学研究院金鑫研究员,陆军军医大学邓国宏教授,北京大学黄岩谊教授,清华大学生命学院郗乔然研究员,复旦大学上海医学院陆路研究员)在免疫学顶级期刊《自然-免疫学》(Nature Immunology)发表研究论文《IGHG1变异体表现出极化分布并增强针对危险致病生物的IgG1抗体防护反应》(An IGHG1 variant exhibits polarized prevalence and confers enhanced IgG1 antibody responses against life-threatening organisms)。这项研究发现人类记忆性B细胞所主要使用的IgG1型抗原受体(IgG1-BCR)膜联重链的胞内信号转导区ITT-Tyr下游正五位的G396R变异体(rs117518546,IgG1-G396R)在东南亚中南半岛为主的周边地区人群呈现超高频分布,并能增强针对危险致命生物的IgG1型抗体防护反应。整合分析现代人古代个体的遗传学数据和已经灭绝的古智人DNA数据,揭示该变异体最早出现在抗体编码基因组的人种(古智人和现代人)是五万年前的尼安德特古智人,且可能与2022年诺贝尔奖得主Svante Pääbo发现于欧洲巴尔干半岛的尼安德特古智人(Vindija个体)最直接相关。这一发现对于理解来自环境的选择压力如何在万年时空中塑造人群遗传结构,以及适应性免疫系统如何通过调控记忆性B细胞抗原受体IgG1-BCR的跨膜信号转导,来增强人类抵御病原体的免疫力,具有重要的生物医学意义。

环境中的有害生物(包含各类病原体,毒蛇和毒蘑菇等动植物毒素)是人类进化中选择压力的主要来源。人类个体的基因多态性(genetic polymorphism,遗传变异)影响了不同个体对病原体感染的免疫力。理论上,环境中有害生物体的地理分布和攻击强度可以决定与免疫反应相关的遗传变异在全球不同人类族群中的保留与固定频率。作为适应性免疫力的启动器、放大器和记忆性免疫力的储存与提取模块,人类记忆性淋巴细胞的抗原受体复合物的相关遗传变异,极有可能在人类族群中展现出一定的保留和固定痕迹。围绕这个极具挑战性和趣味性的科学问题,刘万里教授与国内外的合作者,以人类IgG1抗体重链编码基因IGHG1的一个单核苷酸级别的基因多态性(rs117518546,IgG1-G396R)为研究起点,开展了一系列由浅入深、交叉学科紧密结合的研究工作。IgG1-G396R影响IgG1型抗原受体膜联重链胞内信号转导区ITT-Tyr下游正五位的编码氨基酸(从不带电最小尺寸甘氨酸G,突变为带正电具有很大氨基酸侧链的精氨酸R)。刘万里团队此前的研究已证实IgG1-G396R为系统性红斑狼疮的新风险因子(Science 2018),也是结直肠癌的新保护因子(JCI 2022)。上述工作发表后,国内外多个研究团队陆续揭示IgG1-G396R在其他临床疾病中的差异性作用。因此,基于上述基础和临床医学研究,分析IgG1-G396R这一遗传多态性在人类种群的分布和起源,并阐明其与疾病易感性及人类进化史的关系,是一个极具科学意义和临床价值的课题。
首先,项目联合研究团队分析全球不同大陆和次大陆现代人的超万人级别的大队列人群基因组数据(GnomAD和1000 Genomes),以及小队列但是包含142种稀少人类族群的西蒙斯基因组多样性计划数据库(Simons Genome Diversity Project)。让人意外的发现是,IgG1-G396R变异体在全球人口出现显著两极化分布态势,其在非洲,欧洲,美洲和大洋洲的主体人口中出现频率极低(minor allele frequency,MAF,仅为万分之几),但是在如下族群人口中频率较高:Bougainville population; Hawaiian population; Dusun population in Malaysia; Chinese Dai in Xishuangbanna; She population in China; Thai from Thailand; Kinh in Ho Chi Minh city, Vietnam; Southern Han Chinese, China; Chinese Han in Beijing, China; Bengali in Bangladesh。
形成鲜明对照且极为有趣的是,这些超高频率的人群在地理位置上展现了集中在东南亚中南半岛地区及其周边人群的趋势,但是IgG1-G396R在同为东亚国家的日本、韩国人群中比例明显低于上述地区的人群,并且在同为上述地区的巴布亚新几内亚和澳大利亚土著个体中并未出现,表明IgG1-G396R可能与某些种族人群以及特定区域的地理、历史、生物学的关键事件是紧密关联的(此类事件的本质,此论文尚未可知,尚需进一步交叉学科深入研究)。通过对群体遗传学数据的分析发现IgG1-G396R在上述地区的人群中位于一个约300kb的连锁不平衡(LD,Linkage disequilibrium)区块上,而且具有较高的固定指数(Fst);进一步的基因连锁分析发现在300kb的LD区块中IgG1-G396R位点所在的更为突出的190kb大小的LD区块进一步展现了较低的核苷酸多样性、Tajima D的负值,在选择性清除分析中展现了较高的被选择可能性,上述医学遗传连锁分析揭示以IgG1-G396R为高峰的190-300kb LD区块在进化上受到了强大的正选择压力(图1)。
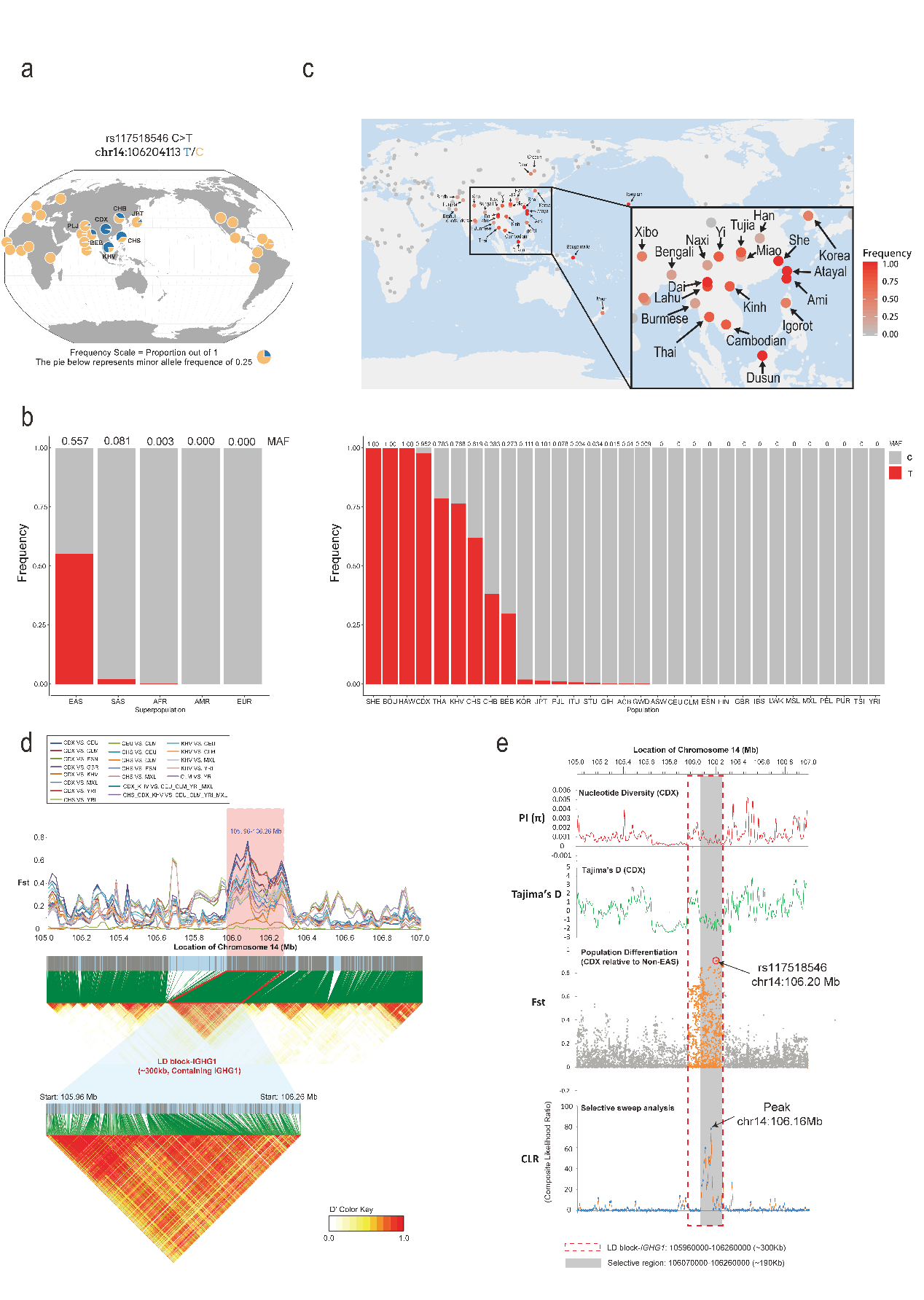
图1 IgG1-G396R变异体在全球人群中的分布情况及其对IGHG1基因座的影响
为了进一步分析该变异体的起源,研究团队利用现代人类族群和古智人个体的基因数据,对190kb LD区块的IGHG1基因座进行主成分分析,发现其与Vindija和Chagyrskaya,这两个尼安德特古智人个体的基因组聚类最为接近。此外与基因组上其他的随机190kb区段相比,尼安德特人的基因渐渗(genetic introgression)信号在此190 kb LD区块的IGHG1基因座尤为显著。通过比较古智人基因组和现代人基因组的IGHG1基因座及其20kb侧翼区域的单倍型,发现Vindija 和Chagyrskaya尼安德特人与现今东南亚及附近地区人群在进化距离上更为接近。更有趣的是,具体到IgG1-G396R变异体位点本身,研究团队发现Chagyrskaya尼安德特人作为一个古智人个体并不携带IgG1-G396R变异体,而Vindija尼安德特古智人可能是IgG1-G396R变异体的杂合子携带者(此古智人个体,被2022年诺贝尔奖得主Svante Pääbo发现于欧洲巴尔干半岛克罗地亚的Vindija山洞,此个体也被其命名为Vindija尼安德特古智人);且在时间轴线尺度,Chagyrskaya尼安德特人的出现也远早于Vindija尼安德特古智人,虽然一般认为两者有共同的远古祖先。更进一步,针对存在于Vindija尼安德特人基因组中,但在非洲尼日利亚的伊巴丹约鲁巴人中超过90%的个体不存在的基因变异(这代表Vindija尼安德特人基因组中特有的单倍型特征)进行更深入分析,也进一步揭示这种尼安德特人单倍型在现今东南亚及其相关附近地区人群中的频率最高发。最后,通过调查UK千人基因组数据库中与G396R变异体紧密连锁的9个单核苷酸多态位点(SNP),发现这9个SNP的分布与IgG1-G396R高度相似,而且这9个SNP均存在于 Vindija 和 Chagyrskaya 尼安德特古智人的基因组中。综合上述针对古智人的基因组分析和对东南亚主体人群和周边岛屿的土著人群的研究结果表明,IgG1-G396R变异体可能是在尼安德特古智人单倍型背景上富集(假说一),和/或出现在东南亚及其周边人群的古代祖先中(假说二),虽然两个假说并不绝对互斥(图2)。
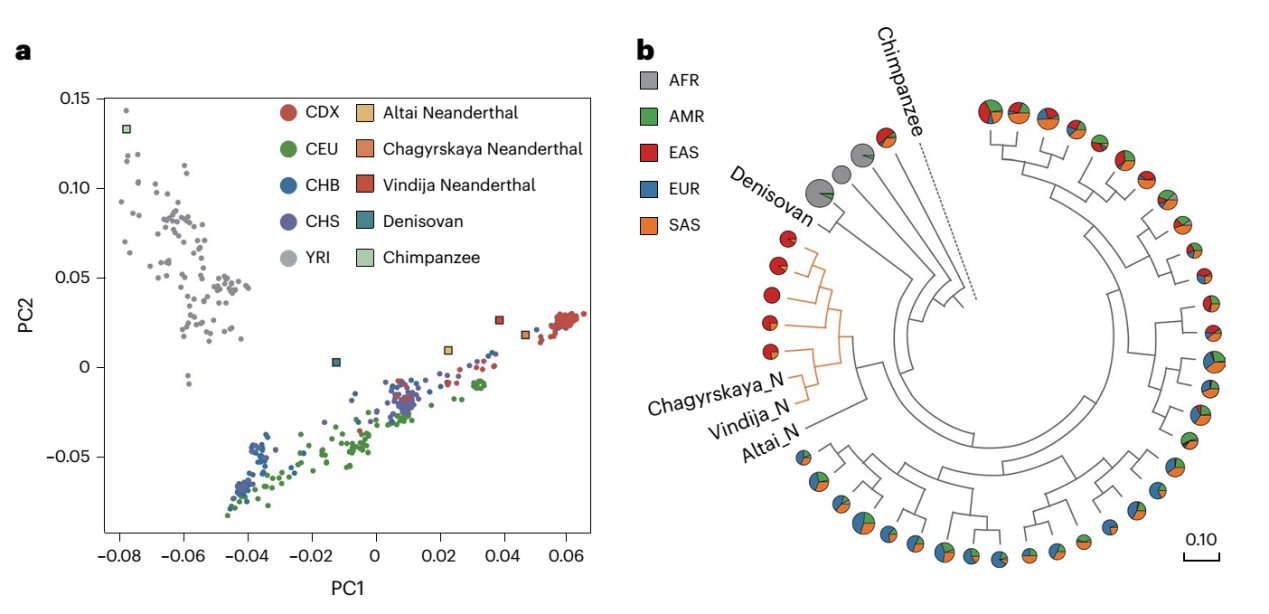
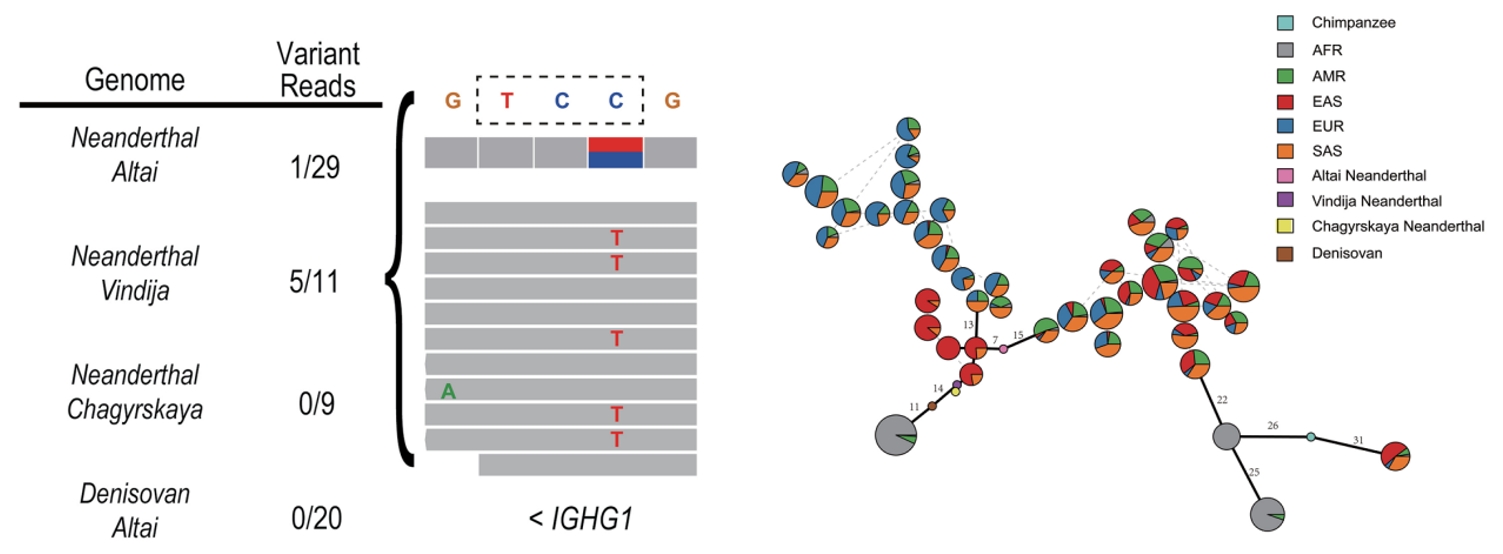
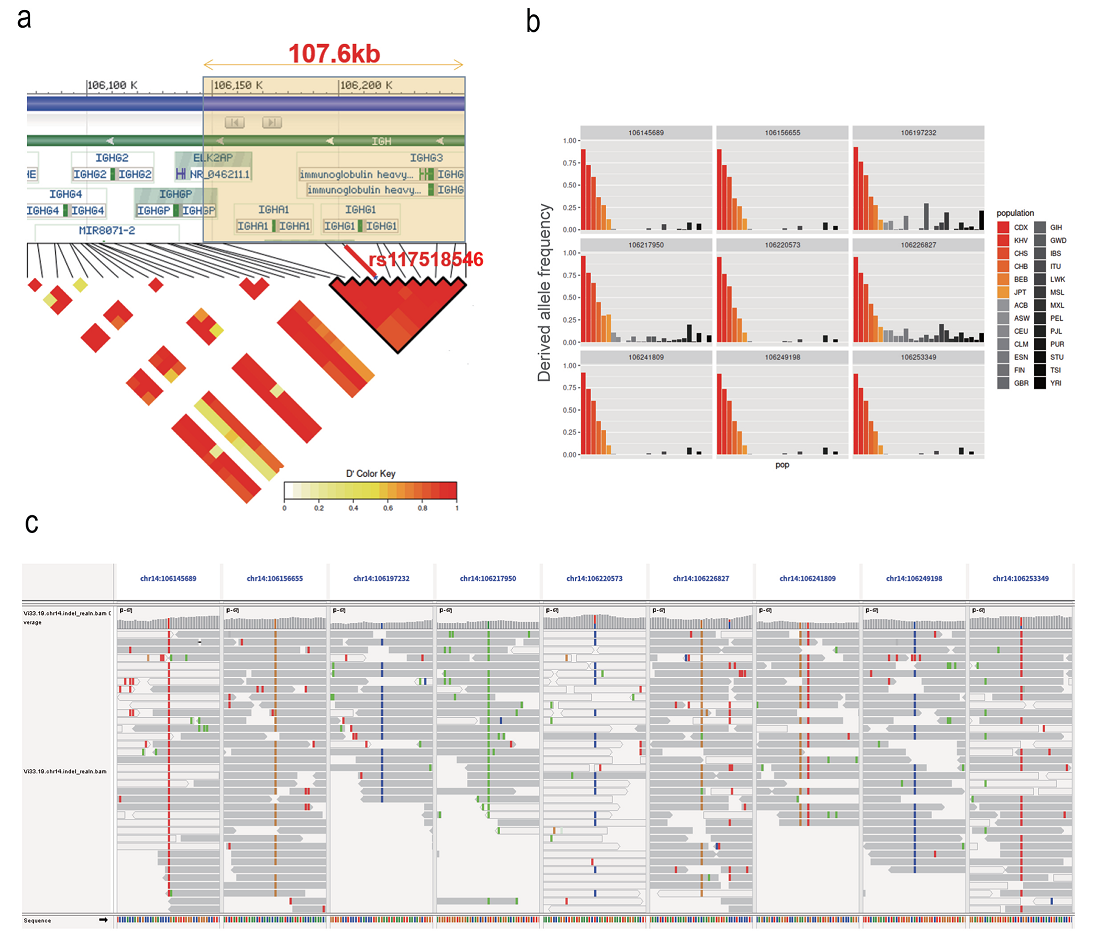
图2 IgG1- G396R变异体可能源自尼安德特古智人的单倍型背景
为了探索图1中揭示的以IgG1-G396R为高峰的190-300kb LD区块在进化上受到了强大的正选择压力的源泉,并从功能上进一步证明IgG1-G396R携带者的确具有进化选择优势。研究团队在小鼠模型中实施肺炎链球菌,新冠病毒,沙门氏菌,银环蛇蛇毒(α-BGT)等多种低剂量免疫联合高剂量攻毒致死实验,发现IgG1-G396R能够通过增强抗体应答,提高机体对病原微生物及毒蛇毒素的抵抗作用。更重要的是,联合攻关团队通过对中国深圳和武汉的两个COVID-19病例队列以及相应的健康对照进行流调和遗传分析,发现IgG1-G396R与COVID-19的易感性存在显著相关性。更进一步地利用PBMC来源的RNA测序数据,研究团队发现IgG1-G396R与多个B细胞活化相关基因的表达水平显著相关,提示该变异体可能通过增强淋巴细胞的免疫活化来影响机体免疫功能;针对COVID-19病人队列的血清蛋白组学分析也确认IgG1-G396R与多个淋巴细胞的免疫活化相关信号转导蛋白簇的丰度存在显著关联。项目团队在接种新冠疫苗的志愿者临床队列研究中,招募IgG1-396R的纯合携带者和IgG1-396G的纯合携带者,发现IgG1-396R的纯合携带者在接种新冠疫苗后产生的抗体水平和中和抗体效价明显更高,进一步证实IgG1-G396R变异体对人类免疫功能的增强作用。在小鼠新冠感染实验中,研究人员构建了携带人ACE2转基因(hACE2-Tg)和人IgG1-G396R对应小鼠基因突变的基因敲入小鼠(IgG1-G390R-KI),发现hACE2-Tg和IgG1-G390R-KI的双基因修饰小鼠在SARS-CoV-2感染后表现出更强的免疫防御能力。
综上所述,项目联合攻关团队的一系列交叉学科的研究结果揭示了宿主遗传变异作为疾病表型的影响因素的重要性,特别是在新发SARS-CoV-2传染病和其他人类历史上的感染事件中的潜在作用,这些发现为开发新的疫苗策略和治疗手段提供潜在的生物医学理论框架。此外,该研究还揭示环境中的复合型选择压力(含病毒,细菌类病原体,并叠加毒蛇毒蘑菇等动植物毒素),如何在几万年时空中综合包括历史、地理、生物在内的复合型事件因素,完成塑造人类群体的适应性免疫分子的遗传结构提供了新的科学见解和新的研究范式。
清华大学生命学院、生命中心PI、免疫学研究所、膜生物学全国重点实验室的刘万里教授是论文的首要通讯作者(lead corresponding author),西湖大学医学院陈相军研究员,华大生命科学研究院金鑫研究员,陆军军医大学邓国宏教授,北京大学黄岩谊教授,清华大学生命学院郗乔然研究员,复旦大学上海医学院陆路研究员是本文的共同通讯作者(co-corresponding author)。本研究的完成需要大力整合临床免疫学、基础免疫学、分子进化生物学、分子细胞生物学、古人类学、疫苗学、医学遗传学、传染病学等多学科的交叉优势,因此本项目由国内外多家研究团队,常年攻关,紧密配合,方予完成。作为总结,清华大学孙文博博士,北京大学杨婷玉博士,重庆医科大学孙凤明博士,复旦大学徐巍博士,以及华大生命科学研究院的刘盼红,蓝贤梅和清华大学高吉博士研究生为本论文的共同第一作者。具体来说,清华大学孙文博博士负责分子细胞免疫学和病原体感染免疫学及文章整理工作,北京大学杨婷玉博士负责古人类分子进化分析工作,重庆医科大学孙凤明博士负责分子医学遗传学分析工作,华大生命科学研究院刘盼红、蓝贤梅负责新冠病人临床队列分析,清华大学高吉负责新冠患者测序数据库再分析,复旦大学徐巍博士负责hACE2-Tg和IgG1-G390R-KI的双基因修饰小鼠在BSL-3实验室的攻毒和病理分析工作。研究过程得到来自清华大学张林琦教授,张敬仁教授,韩国成均馆大学Han-Na Kim教授(负责提供并分析韩国新冠病人的万人级别的大型队列数据),中国科学院动物研究所翟巍巍研究员,华中科技大学程范军教授,深圳市第三人民医院王方教授,华大生命科学研究院朱焕焕,陆军军医大学谭文婷副研究员,北京大学庞玉宏副研究员,清华大学梁清泰博士,李翠峰博士,和刘晓航,陈浩泽,李桐博士研究生的大力支持。本研究团队还致谢清华大学王建斌研究员,娄智勇教授,向烨研究员,中国科学院古脊椎动物与古人类研究所的付巧妹研究员,复旦大学BSL-3实验室工作人员(蔡霞,胡高维,焦凡珂,邢立晓和闫妍),澳大利亚悉尼加文医学研究所Owen Siggs博士,荷兰Helen Pickersgill博士,以及泰国朱拉隆功大学、日本东京大学和理化研究所相关科研人员在科学问题讨论和实验材料方法方面的大力协助。项目联合研究团队得到国家自然科学基金委杰青项目、重大研究计划、专项项目、重点项目,国家科技部重点研发计划,北京自然科学基金重点项目,深圳医学科学研究院临床专项项目,清华大学春风基金、生命科学联合中心、清华大学免疫学研究所、清华大学万科公卫学院的基金资助。
原文链接:https://doi.org/10.1038/s41590-024-01944-4
特别说明:本论文核心结论数据,早在2022年5月投稿生物医学领域学术期刊的过程中,借助杂志社提供的预印本公开渠道,在全球互联网范围内对同行和公众,予以全文公开:
https://doi.org/10.2139/ssrn.4102635
https://europepmc.org/article/PPR/PPR606785
招聘信息:
博士后和研究助理招聘广告(长期有效):刘万里团队致力于抗原受体介导的免疫识别、免疫活化、抗体应答及相关疾病的研究,在国内外主流的生物医学期刊共计发表SCIE收录的研究论文百余篇(Science、Cell、Science Immunology、Nature Immunology、Immunity x2、PNAS、J Clin Invest、J Exp Med x3、Ann Rheum Dis、Cell Research x2、Protein Cell x2、Cell Discovery、Nature Communications x4、Science Advances、PLoS Biology、Science Signaling、J Cell Biol、J Allergy Clin Immunol、Leukemia x2、J Immunol x4、eLife x4等);发表的论文共计被引用超过6600次(根据2024年9月谷歌学术统计)。曾获中国青年科技奖、药明康德生命化学杰出成就奖、谈家桢生命科学奖、树兰医学奖、英国科学会牛顿高级学者奖等奖项。相关科研项目曾获中国十大医学科技新闻、教育部自然科学奖、中华医学科技奖、中国生物工程学会优秀专利奖、北京市医学科技奖、湖北省自然科学奖等相关奖项。刘万里获国家杰青、教育部长江学者特聘教授、科技部科技创新领军人才、国家高层次青年人才等支持。研究得到国家基金委重点项目x2(项目负责人)、NFSC-NIH三年期项目(项目负责人)、优青项目(项目负责人)、专项项目(课题负责人);科技部重点研发计划(项目首席)、863(青年科学家项目)和973(课题负责人);北京市基金委重点项目(课题负责人);梅琳达盖茨基金会项目(项目负责人)等支持。长期招聘博士后(免疫学博士为佳)、研究助理(本科生为佳)和技术员(中学毕业即可),仅限对相关研究有强烈兴趣且致力于学术研究者来申请(Email: LiuLab@Tsinghua.edu.cn)。
相关领域的国内外专家点评(排名不分先后)
点评 | 闻玉梅(中国工程院院士,美国微生物科学院院士,复旦大学上海医学院教授,医学微生物学家,分子病毒学家)
2024年9月11日,清华大学生命学院、生命中心PI、免疫学研究所、膜生物学全国重点实验室的刘万里教授,与国内的多位交叉学科合作者(西湖大学医学院陈相军研究员,华大生命科学研究院金鑫研究员,陆军军医大学邓国宏教授,北京大学黄岩谊教授,清华大学生命学院郗乔然研究员,复旦大学上海医学院陆路研究员),在《自然-免疫学》(Nature Immunology)发表研究论文《IGHG1变异体极化分布并增强针对病原体威胁的IgG1抗体防护反应》(An IGHG1 variant exhibits polarized prevalence and confers enhanced IgG1 antibody responses against life-threatening organisms)。
这是一篇有价值的生物医学研究论文,基于IgG1+记忆性B细胞的抗原受体驱动的抗体应答,分别从遗传学、蛋白质学、抗感染免疫学等进行了多方位的交叉学科合作探索。从人类群体的适应性进化演变分析发现人类IgG1膜联抗体编码基因IGHG1(重链)G396R变异体(IgG1-G396R,rs117518546),主要分布于东南亚地区等相关国家地区;进一步揭示IgG1-G396R变异体能够通过增强抗体应答,促进机体对病原微生物(细菌,病毒等)的抵抗作用;后续的蛋白质组学分析也验证了IgG1-G396R变异体与多个淋巴细胞免疫活化相关的信号转导蛋白的丰度存在显著关联。这些研究结果为开发新的疫苗策略和治疗手段提供了潜在的生物学基础。
机体抗病原体是一个复杂的过程。发展多学科合作优势以及基础研究与防治疾病结合是一个良好的开端。希望今后国内能多一些旨在揭示理论问题、加强交叉学科合作的氛围与途径。
点评 | 张学(中国工程院院士,中国医学科学院长聘教授,医学遗传学家),
黄波(中国医学科学院长聘教授,分子免疫学家)
传染病是人类生存的重大威胁。在漫长的进化过程中,人类逐渐演化出复杂的免疫系统识别并清除病原体以抵御各种传染病。同时,自然界中的有毒有害生物(如病毒、细菌、病原体相关的蚊虫、毒蛇和毒蘑菇等)也不断对人类的基因多态性(gene polymorphism)进行选择,从而增强了人类对环境的适应性。虽然适应性免疫受体在影响人群对这些有害生物的抵抗能力方面起着关键作用,关于这些受体的基因多态性如何影响人类的免疫反应和基因结构分布,仍未完全解答。
2024年9月11日,清华大学生命学院、生命中心PI、免疫学研究所、膜生物学全国重点实验室的刘万里教授与多位国内外的交叉学科合作者在《Nature Immunology》期刊发表题为《An IGHG1 variant exhibits polarized prevalence and confers enhanced IgG1 antibody responses against life-threatening organisms》的研究论文。此工作围绕人类记忆性B细胞主要使用的IgG1型抗原受体(IgG1-BCR)中G396R变异体(rs117518546,IgG1-G396R),探索G396R的分布、在抵御病原体和蛇毒毒素中的作用(评价系统为基于基因修饰小鼠的免疫攻毒模型)、潜在的起源,以及其与人类迁徙和进化的可能联系。
研究首先通过分析全球不同大陆和次大陆人群的基因组数据,发现IgG1-G396R在东南亚中南半岛的本地人群(含部分岛屿土著人群)中高频分布,而在非洲、欧洲、美洲和澳洲的主要人群频率极低。为分析该变异的进化选择优势,研究团队采用了多种小鼠免疫后攻毒致死模型,发现IgG1-G396R可以增强抗体应答,促进机体对病原微生物和蛇毒的抵抗能力。研究团队对中国,韩国和日本多临床中心公开发表的新冠队列及健康队列进行流行病学分析,发现IgG1-G396R变异体与COVID-19的易感性存在显著关联。携带IgG1-G396R变异体的志愿者在接种新冠疫苗后产生的抗体水平和中和抗体效价显著更高,进一步证实了这一变异对免疫功能的增强作用。小鼠模型实验也表明,携带此变异体的基因敲入小鼠(equivalent knock-in + hACE2 mice)在感染SARS-CoV-2后表现出更强的免疫防御能力。
最后,研究团队结合远古人类基因组数据,并与现存人类进行比较,推测出IgG1-G396R变异体可能在尼安德特人单倍型背景上富集,或是出现在东南亚本地现代人的演化过程中。
此工作整合了临床免疫学、基础免疫学、分子细胞生物学、进化生物学、流行病学、医学遗传学和古人类学等多学科的研究优势,深入探讨了IgG1-G396R变异体的功能与起源,提供了全新的视角。另外,此研究通过分析古智人与现代人融合进化的视角,探讨了适应性免疫基因的形成过程,有助于我们理解适应性免疫与病原体共同进化的复杂现象。这些研究为新疫苗和治疗手段的开发提供了新的基础和思路,特别是在当今日益常见的呼吸道感染及重大流行性疾病背景下,本研究为理解基因变异与人类种群在自然选择压力下的适应性提供了新的方向。
点评 | 付巧妹研究员及其团队E. Andrew Bennett副研究员(付巧妹博士现为中国科学院古脊椎动物与古人类研究所研究员,发展中国家科学院青年通讯院士,分子古生物学家)
This multifaceted approach by an interdisciplinary collaboration lays out an impressive genetic history and functional study of the IgG1-G396R immunoglobulin heavy chain variant, which is demonstrated to enhance immunity response against pathogens such as Streptococcus pneumoniae and COVID-19. The identification of this mutation within introgressed Neanderthal genomic sequence adds IgG1-G396R to other examples of adaptive introgression from archaic humans, such as TNFAIP3 and EPAS1. Although the rarity of the variant outside Southeast Asia, coupled with its apparent occurrence in European but not Asian Neanderthals, creates additional questions surrounding the history of the introgression event and the diverse selective landscape that challenged our ancestors, this study nevertheless affirms the role genetic diversity of lost human lineages continues to play in present-day human populations.
点评 | 丹尼尔-林伍德教授(Ragon Institute for MGH,MIT and Harvard)
“This is a very interesting finding, spanning disciplines of basic B cell immunology, vaccine science, biomedicine and human evolution; ultimately describing a genetic polymorphism that tunes antibody responses (likely generally) following immune challenge. The implications across the above disciplines are wide.” Daniel Lingwood, Ragon Institute of MGH, MIT and Harvard, Cambridge, USA.
此项点评为Nature Immunology配发Research Briefing内容,非研究团队邀约,具体见:https://doi.org/10.1038/s41590-024-01944-4
