2024年11月8日,清华大学基础医学院、免疫学研究所、肿瘤研究中心和生命中心林欣教授团队在Cell子刊《Cell Reports》杂志上在线发表题为“TCR-mimicking STAR conveys superior sensitivity over CAR in targeting tumors with low-density neoantigens”的文章,报道了新型嵌合抗原受体STAR在靶向低丰度新抗原肿瘤中的高敏感性潜力,有望推动T细胞免疫疗法进入更加精准和高效的时代。
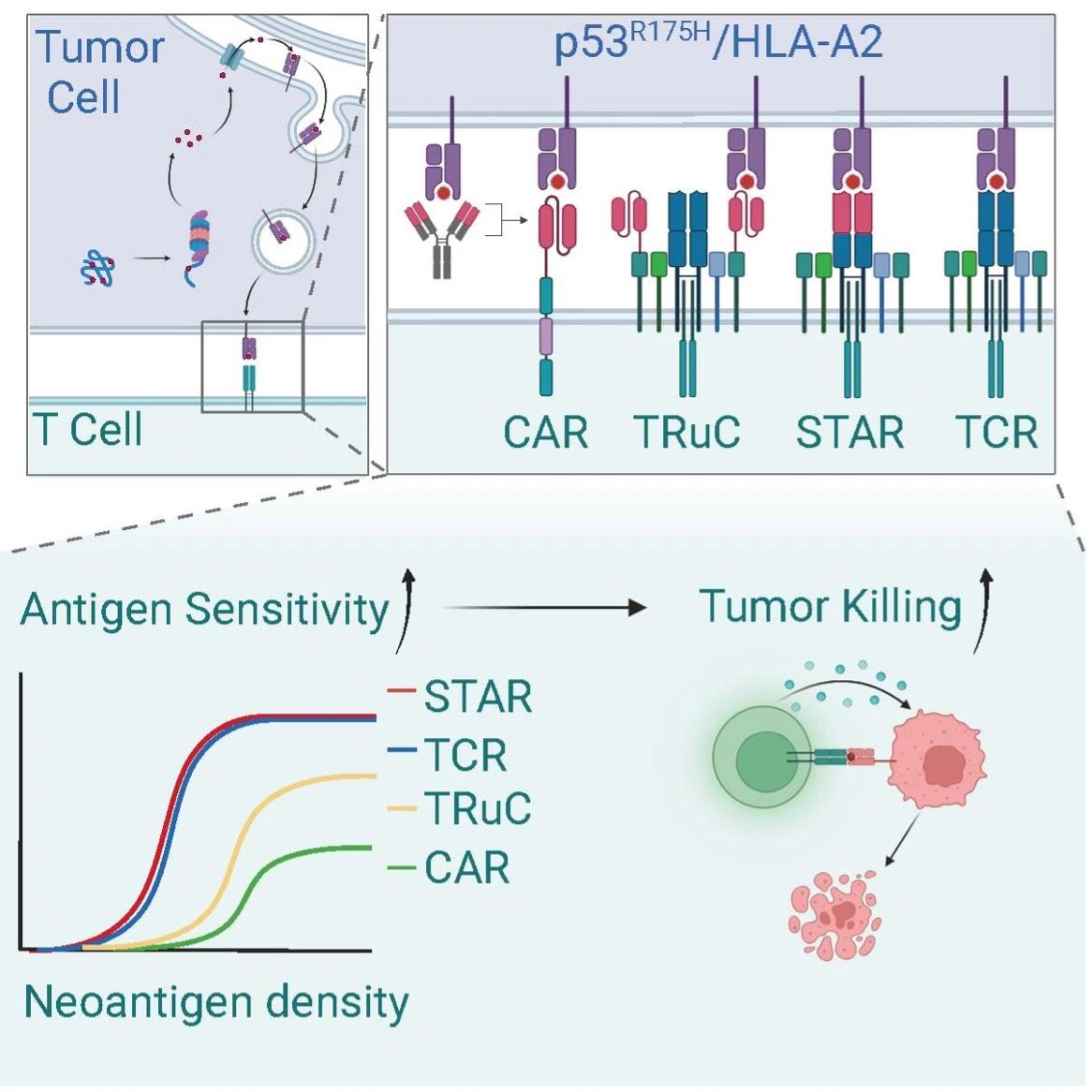
图1. 文章图文摘要
研究背景:突破实体瘤免疫治疗瓶颈
过继性T细胞疗法(ACT)在血液恶性肿瘤的治疗中已取得显著成效,但在实体瘤治疗方面依旧面临诸多挑战。实体瘤中肿瘤特异性抗原(tumor-specific antigen, TSA)较为稀缺,使得现有T细胞疗法在识别和杀伤肿瘤细胞时效果有限。目前,T细胞疗法主要依赖T细胞受体(T cell receptor, TCR)或嵌合抗原受体(chimeric antigen receptor, CAR)靶向肿瘤相关抗原(tumor-associated antigen, TAA)。但由于TAAs在健康组织中的表达,易引发脱靶毒性,增加治疗副作用。相比之下,肿瘤新抗原(neoantigen)因源于肿瘤特异性突变,不存在于正常组织中,因此能够为癌症免疫疗法提供更具特异性的靶点,减少对健康组织的毒副作用。然而,由于肿瘤细胞抗原处理机制的缺陷等原因,影响新抗原在肿瘤细胞表面被HLA分子有效呈递,从而削弱了T细胞对肿瘤的识别能力。如何有效靶向低丰度新抗原肿瘤以克服肿瘤的免疫逃逸,成为癌症免疫治疗中的关键难题之一。
在T细胞免疫疗法中,CAR和TCR两类受体各具特点,但由于它们传统上靶向不同类型的抗原,直接进行对比存在较大难度。传统认为,CAR通常靶向细胞膜蛋白,具有较高的亲和力,但敏感性较低;相反,天然TCR靶向由HLA分子呈递的多肽,包括新抗原,展现出更高的敏感性,但亲和力相对较低。因此,在靶向相同抗原,尤其是肿瘤特异性新抗原的条件下,系统性地比较CAR和TCR的抗原识别能力和抗肿瘤效能具有重要的研究意义。
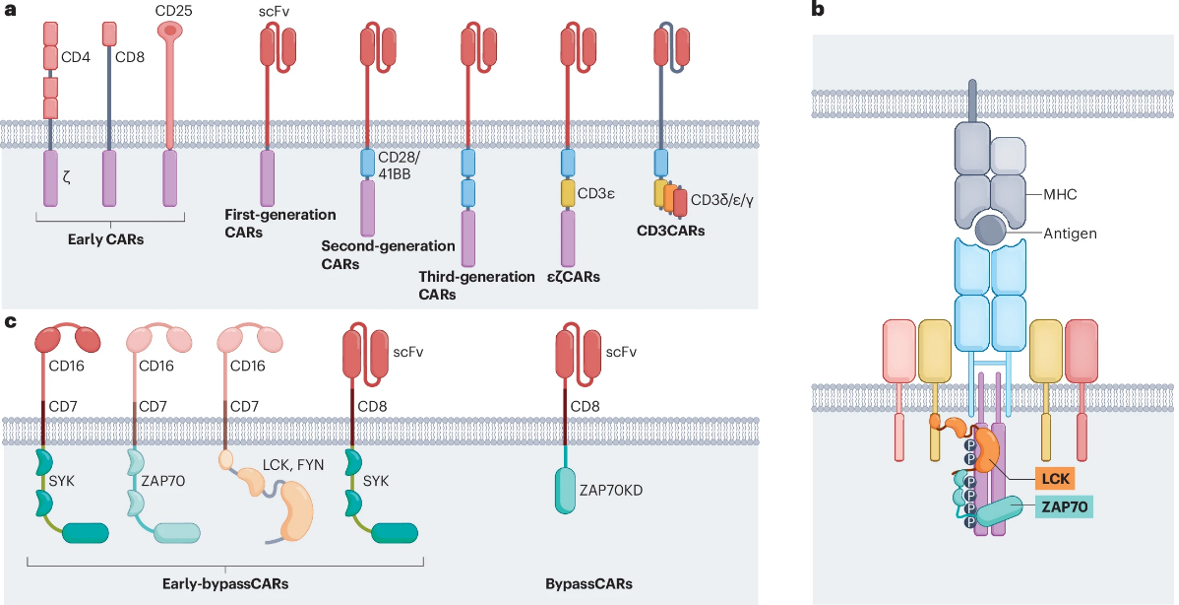
图2. CAR和 TCR的结构比较.1
目前对CAR的抗原敏感性优化策略主要可以分为两种途径:
1. 改造现有CAR结构:这是目前大多数研究论文采用的策略,通常通过对CAR的胞内信号域、胞外结构或连接区域进行优化,以提升其抗原识别能力。然而,这些优化方法虽然在特定抗原环境下有效,但由于CAR与TCR靶向的抗原类型不同,其优化效果难以与TCR的天然抗原敏感性进行直接对比。
2. 设计TCR-like嵌合受体2:该策略旨在融合TCR的结构特性,从而提升抗原敏感性。代表性成果包括清华大学免疫所林欣教授团队于2021年报道的创新型嵌合受体STAR(Synthetic T cell receptor and Antigen Receptor),以及其他研究团队开发的TRuC(TCR-fusion Construct)、abTCR, TAC和HIT(HLA-Independent TCR)。这些TCR-like受体设计模仿了TCR的抗原识别方式,展现出更高的抗原敏感性。
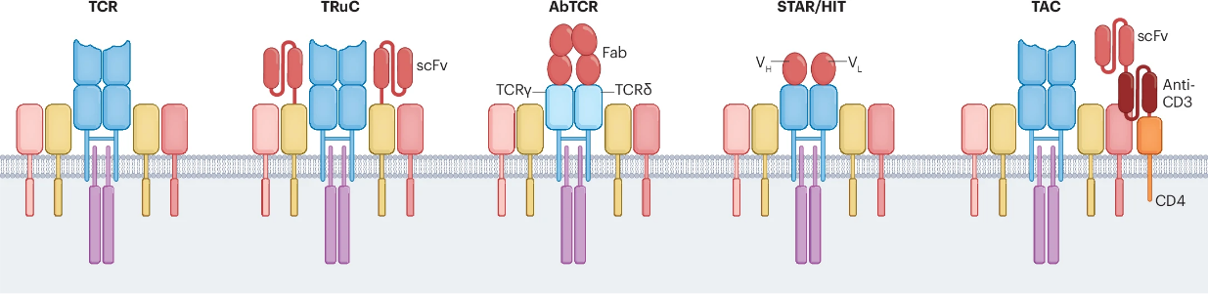
图3. TCR-like嵌合受体.1
STAR和HITs在靶向膜蛋白时已被证明比CAR具有更高的抗原敏感性,但目前尚无研究显示这两种受体的抗原敏感性能达到或超越天然TCR的水平。近期的一项研究表明,STAR在识别肿瘤相关抗原时的抗原敏感性接近TCR2。然而,至今仍缺乏对CAR、STAR、TRuC和TCR在低密度新抗原的实体瘤中抗原敏感性和抗肿瘤能力的系统性比较。这一对比研究将为众多嵌合抗原受体的抗原敏感性研究补上“最后一块拼图”,从而更全面地理解不同抗原受体在肿瘤免疫治疗中的潜力和适用性。
主要研究发现:
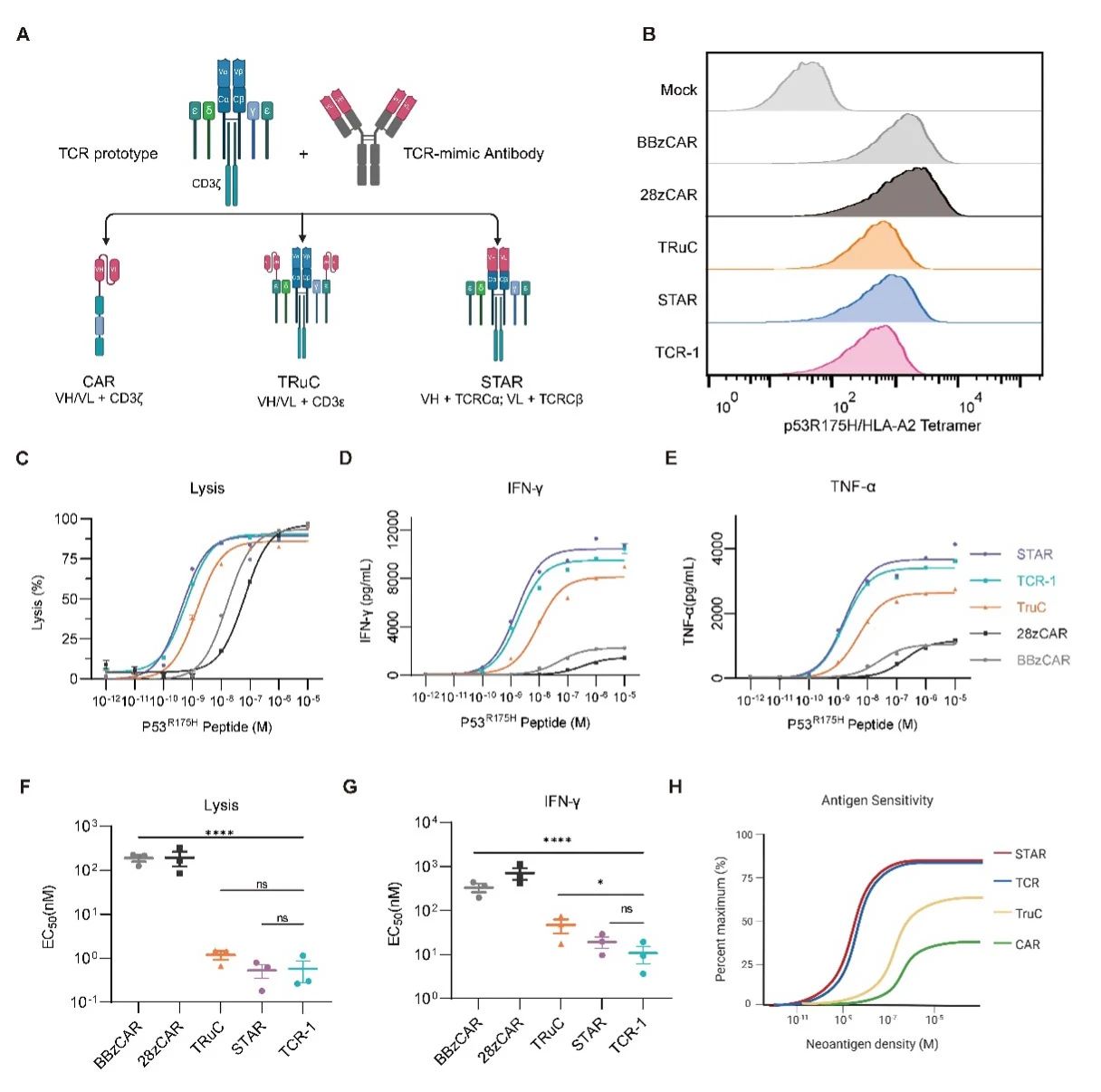
此次研究首次系统地对比了CAR和TCR在靶向同一新抗原时的表现,尤其是在模拟实体瘤低新抗原丰度的条件下。研究发现,CAR-T细胞的抗原敏感性比TCR-T细胞低约10-100倍。此外,本研究通过对比STAR、CAR、TRuC和TCR靶向同一新抗原的效果,揭示了TCR结构在提高抗原敏感性中的重要性。结果显示,STAR能够完全复制TCR的抗原敏感性,而TRuC部分地再现了TCR的高敏感性,而CAR的敏感性最低。通过在体内外的广泛抗肿瘤实验,研究表明STAR相比于CAR的抗原敏感性提升明显,从而增强了其在低密度新抗原肿瘤中的杀伤效果。
本研究主要发现:
· 敏感性和特异性提升:
相比于CAR,STARs能够最佳地复刻TCR对低丰度新抗原的高敏感性,并且STAR是目前唯一报道的最佳地复刻TCR抗原敏感性的嵌合受体。
· 广泛的抗肿瘤活性:
STARs细胞在低密度新抗原肿瘤模型中的表现远超传统的CAR-T细胞和TRuCs细胞,显著增强了对多种实体瘤的攻击力。这些实验表明STARs在恶性实体瘤的治疗中具有广阔的应用潜力。
· 协同作用机制:
STAR结合了抗体的高亲和力和TCR的高敏感性,使其能够在不依赖CD8共受体的情况下,识别并靶向HLA-I类呈递的肿瘤新抗原。STARs这一特性发挥了CD8+和CD4+ T细胞的协同抗肿瘤效应。
研究团队表示,他们将继续优化STAR的结构设计,以提升其在复杂肿瘤微环境中的适应性和持久性。同时,研究团队计划进一步评估STAR-T细胞在临床应用中的长期安全性、疗效持久性及免疫逃逸机制,以确保其在实际应用中的安全性和效果。
综上所述,本研究提出了一种创新的嵌合抗原受体STAR,在靶向低丰度新抗原的肿瘤治疗中展示出卓越的治疗效果。STAR几乎完全再现了TCR的抗原敏感性,并结合了CD8+和CD4+ T细胞的协同抗肿瘤作用,成功靶向HLA -I呈递的新抗原。STAR不仅可在体外实验中展示出强大的抗肿瘤活性,还在小鼠肿瘤模型中验证了其有效性。未来,STAR的应用有望拓展至其他癌症类型和新抗原,通过靶向不同的HLA呈递新抗原,实现更广泛的肿瘤治疗潜力。
生命中心PI林欣为本文的通讯作者,清华大学基础医学院博士生黄道盛和李饴为本文的第一作者,清华大学基础医学院博士后孙克用为本研究作出重要贡献,本项目的研究得到了清华大学基础医学院傅阳心教授实验室和蓝勋副教授实验室的大力支持。本次研究获得了国家自然科学基金委员会(NSFC)、生命科学联合中心以及昌平实验室等多个基金项目的支持。
原文链接:
https://www.cell.com/cell-reports/fulltext/S2211-1247(24)01300-7
参考文献:
1. Minguet, S., Maus, M.V. & Schamel, W.W. From TCR fundamental research to innovative chimeric antigen receptor design. Nat Rev Immunol (2024). https://doi.org/10.1038/s41577-024-01093-7
2. J. Burton, J.A. Siller-Farfán, J. Pettmann, B. Salzer, M. Kutuzov, P.A. van der Merwe, O. Dushek, Inefficient exploitation of accessory receptors reduces the sensitivity of chimeric antigen receptors, Proc. Natl. Acad. Sci. U.S.A.120 (2) e2216352120, https://doi.org/10.1073/pnas.2216352120 (2023).
