生命中心PI、清华大学生命学院、清华大学免疫学研究所(免疫所)、膜生物学全国重点实验室、教育部蛋白质科学重点实验室的刘万里团队与北京协和医院风湿免疫科郑文洁和生命中心PI、清华大学药学院张永辉团队,近来在《自然-通讯》(Nature Communications)杂志在线发表研究论文《TNF抑制剂靶向中性粒细胞中的甲羟戊酸代谢物/TRPM2/钙信号轴,缓解白塞血管炎》(TNF inhibitors target a mevalonate metabolite/TRPM2/calcium signaling axis in neutrophils to dampen vasculitis in Behçet`s disease)。本论文从免疫细胞代谢调控和质膜离子通道,协同增强细胞反应活性的全新角度,揭示雄霸全球近20年的药王---肿瘤坏死因子(TNF)抑制剂在缓解白塞血管炎方面的新型细胞功能和分子机制,为其他类型的自身免疫和炎症性疾病的临床治疗提供新机制和新思路。

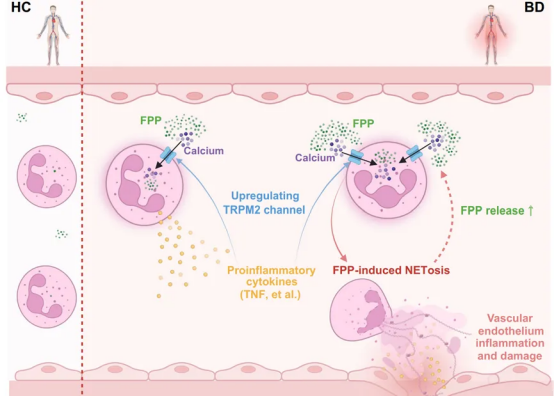
甲羟戊酸通路(MVA)是细胞内重要的代谢途径,负责胆固醇及多种生物活性脂质的合成,对维持细胞膜结构和功能至关重要。除基础代谢功能外,MVA通路还在免疫调节和炎症反应中发挥关键作用,与多种自身免疫性疾病和代谢疾病的发生密切相关。其中,法尼基焦磷酸(FPP)作为MVA通路的关键中间产物,具有多种生物学功能,并在炎症反应和免疫细胞功能等方面发挥重要作用。本研究首次提出,TNF抑制剂可能通过下调TRPM2的表达量,抑制FPP的促炎作用,进而减轻白塞病-中性粒细胞的过度活化及血管炎症。这一发现进一步证实了TNF抑制剂在治疗自身免疫疾病中的重要性,并从MVA及FPP的角度解释了其被誉为“药王”的原因。2018年,生命中心张永辉、石彦、刘万里团队联合攻关,在《Cell》期刊在线发表共同通讯作者的研究论文(The mevalonate pathway is a druggable target for vaccine adjuvant discovery)。该研究揭示MVA通路可作为新型疫苗佐剂的理性设计药物靶点,从而增强抗体应答,为疫苗佐剂的开发提供了新的理论基础和应用前景。在此基础上,刘万里团队继续与张永辉团队及北京大学张勇团队合作攻关,2021在PLOS Biology期刊发表了共同通讯作者的研究论文(Farnesyl pyrophosphate is a new danger signal inducing acute cell death)。该研究进一步揭示了MVA通路的中间代谢产物分子,FPP,作为新型危险信号分子的作用机制,阐明其诱发细胞死亡的过程。该发现不仅有助于深化理解中风引起的免疫损伤机制,还为从抑制免疫损伤角度来开发中风治疗药物提供了潜在的新靶点。在此方向连续攻关近十年的最新科研工作中,刘万里团队与北京协和医院风湿免疫科郑文洁团队近来在《Nature Communications》期刊发表共同通讯作者的研究论文(TNF inhibitors target a mevalonate metabolite/TRPM2/calcium signaling axis in neutrophils to dampen vasculitis in Behçet`s disease)。该研究选择了白塞病(BD)这一兼具自身免疫和自身炎症性疾病特征的慢性系统性血管炎,其临床表现包括反复发作的口腔和生殖器溃疡、皮损等,但是其发病机制尚不明确。联合攻关团队通过整合分析白塞病的多组学数据,发现中性粒细胞(PMN)代谢异常可能是疾病发病的重要驱动因素,并通过干预实验筛选出关键代谢物FPP。结果显示,FPP在BD患者血清和PMN中异常增多,且与炎症指标、疾病活动指数和严重程度评分呈正相关。进一步研究发现,FPP通过激活PMN表面的离子通道TRPM2,引发细胞内钙离子信号通路的激活,促进其释放外泌体(NETs)和产生促炎细胞因子,从而加剧血管内皮炎症和损伤。研究还发现,BD患者血清中异常升高的细胞因子TNF可以诱导TRPM2的过表达,形成FPP-TRPM2-TNF/NETs的正反馈环。这一机制从免疫代谢的角度解释了TNF抑制剂能够缓解BD血管炎的临床效果。TNF抑制剂通过阻断TNF诱导的TRPM2表达,显著减轻了中性粒细胞的过度活化和血管炎症。此外,分析公共数据库的结果显示,TRPM2在多种自身免疫和炎症性疾病的中性粒细胞中表达增加,且这些疾病均显示出对TNF抑制剂的良好临床反应,这进一步扩展了TNF/TRPM2轴作为治疗靶点的普适性。通过精准调控FPP-TRPM2-TNF轴,有望开发更高效的新型治疗药物,为BD及其他相关疾病患者提供更有效的治疗方案,同时显著提升治疗的精准性和临床效果。
北京协和医院风湿免疫科直博生张孟昊、清华大学生命学院/生命中心/免疫所的博士后康娜、北京协和医院内科学系临床医学博士后郁欣为该论文共同第一作者,刘万里和北京协和医院风湿免疫科郑文洁教授为论文的共同通讯作者。作为跨学科交叉研究型课题,本研究积极整合临床医学、免疫学、分子成像、细胞生物学、生物化学、药学等不同学科的交叉优势,在研究过程中得到了清华大学药学院张永辉教授及多位国内同行的大力支持。该研究获得了国家自然科学基金委重大研究计划、杰青项目、重点项目、专项项目、青年项目,国家科技部重点研发计划,北京市自然科学基金重点项目,生命中心,中央高水平医院临床科研专项等多项经费支持。
原文链接
https://www.nature.com/articles/s41467-024-53528-3
博士后和研究助理招聘广告(长期有效)
刘万里团队致力于抗原受体介导的免疫识别、免疫活化、抗体应答及相关疾病的研究,在主流生物医学期刊共计发表研究论文百余篇(Science、Cell、Science Immunology、Nature Immunology、Immunity×2、PNAS、J Clin Invest、J Exp Med ×3、Ann Rheum Dis、Cell Research×2、Protein Cell×2、Cell Discovery、Nature Communications×4、Science Advances、Cell Reports、PLoS Biology、Science Signaling、J Cell Biol、JACI、Euro J Immunol×2、Leukemia×2、J Immunol×4、eLife×4等);发表的论文共计被引用接近7000次。曾获中国青年科技奖、华夏医学科技奖、药明康德生命化学杰出成就奖、谈家桢生命科学奖、树兰医学奖、英国科学会牛顿高级学者奖等奖项。相关科研项目曾获中国十大医学科技新闻、教育部自然科学奖、中华医学科技奖、中国生物工程学会优秀专利奖、北京市医学科技奖、湖北省自然科学奖等相关奖项。刘万里获得国家杰青、教育部长江学者特聘教授、科技部科技创新领军人才、国家高层次青年人才等支持。研究得到国家基金委重点项目(项目负责人)、NFSC-NIH三年期项目(项目负责人)、优青项目(项目负责人)、专项项目(课题负责人);科技部重点研发计划(项目首席)、863(青年科学家项目)和973(课题负责人);北京市基金委重点项目(课题负责人);梅琳达盖茨基金会项目(项目负责人)等支持。长期招聘博士后(免疫学博士为佳)、研究助理(本科生为佳)和技术员(中学毕业即可),仅限对相关研究有强烈兴趣者(Email: liulab@mail.tsinghua.edu.cn)。
