研究背景
cGAS-STING信号通路是天然免疫系统的重要组成部分,它的发现回答了免疫学领域的一个重要问题:DNA如何激发天然免疫应答。2024年的拉斯克基础医学奖被授予了西南医学中心的陈志坚(James Chen)教授,表彰其发现了DNA感应蛋白cGAS,揭示了DNA触发免疫和炎症反应的机制。关于cGAS-STING信号通路的来龙去脉,免疫学领域的几位资深科学家也在《免疫》和《新英格兰医学杂志》上进行了清晰阐述【1, 2】。
在STING(2008年)和cGAS(2012年)被发现之后的十几年时间里,cGAS-STING信号通路的研究非常活跃,产生了很多高水平的科研成果,在感染-宿主免疫调控、癌症、代谢免疫、自噬、细胞死亡、衰老、神经退行性疾病以及自身免疫性疾病等诸多领域得到广泛而深入的拓展。近几年,越来越多的研究结果表明,cGAS-STING信号通路和其他领域的信号通路之间存在各种形式的互作(crosstalk and interactions),这些互作的研究虽然还处于初级阶段,但其呈现的态势让人相信相关的研究在未来将不断地深入,进而触发更多令人兴奋的研究成果和应用潜力。
研究内容
2025年1月7 日,生命中心PI、清华大学药学院张从刚研究员在《Nature Reviews Immunology》(自然免疫学综述)杂志在线发表了题为《Regulation of cGAS–STING signalling and its diversity of cellular outcomes》的受邀综述文章。该文章系统总结讨论了cGAS-STING信号通路的核心分子机理,阐述了cGAS-STING信号的激活和抑制调控机制,并梳理了逐渐展现的cGAS-STING通路与其他信号通路的互作。同时,文章阐述了这些调控与互作所介导的多样性的细胞功能,对cGAS-STING在感染、代谢、癌症、炎症、衰老等领域的应用前景以及未来的研究方向进行了前瞻性展望。

文章首先介绍了cGAS-STING信号通路的基本框架(图1),从结构生物学角度对cGAS-dsDNA结合模式、cGAMP与STING的结构、STING可能的配体结合位点,以及STING-TBK1的互作分子机制进行了讨论总结。此外,文章还对cGAS以及cGAS-like receptors在细菌以及整个动物学领域的研究进展进行了总结。cGAS-like蛋白在进化上非常古老,它逐渐被认为是一类pattern-recognition receptors家族(见综述Box 1)。
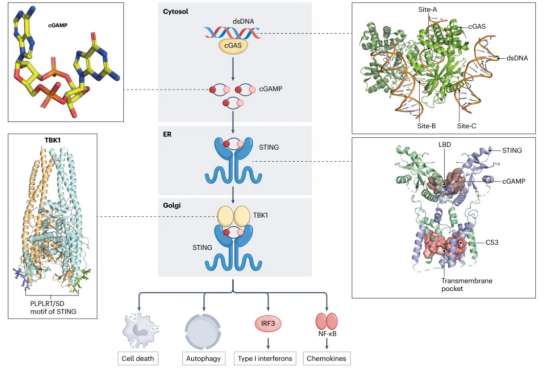
图1. cGAS-STING通路概述
接着,文章系统总结了cGAS-STING信号通路的激活和抑制调控机制(图2)。文章对激活cGAS的各种来源的双链DNA进行了详细的划分,如eccDNA和逆转录元件等;同时也对cGAS在细胞核内被抑制的机理进行了总结。此外,文章中对cGAMP的调控也进行了详细讨论,如目前发现的各种cGAMP转运体和降解酶。在这部分,作者还对STING的转运和对应的调控进展进行了系统性的阐述。 随后,作者总结了cGAS-STING信号通路在微生物-宿主中的代表性的互作机制:如部分病毒中表达的酶能够降解cGAMP或STING实现免疫逃逸。同时,cGAS-STING信号通路与其他的天然免疫信号通路也存在调控互作,将天然免疫中如NLRP3、NLRC3、TLRs、NF-κB等通路与cGAS-STING通路联系起来,绘制出一幅较为完整的天然免疫网络。此外,文章还总结了STING介导的非经典自噬信号通路的调控机制。
代谢免疫学近些年迅速发展,cGAS-STING和代谢的互作、调控和功能也逐渐成为其中的研究热点。文章中作者也对cGAS-STING信号通路与代谢信号逐渐呈现的复杂互作进行了总结和阐述。作者对糖代谢(如三羧酸循环)、脂代谢(如胆固醇)和一些氨基酸代谢如何影响cGAS-STING通路信号进行了详细总结。
最近的一系列研究表明,cGAS-STING信号通路的异常激活,能够触发炎症反应,是衰老和神经退行性疾病的潜在驱动因素(图3)。文章系统总结了cGAS-STING异常激活介导的炎症和自身免疫性疾病的进展,同时也对与cGAS-STING通路相关的衰老和神经退行性疾病(如阿尔兹海默、帕金森症、渐冻症等)进行了简要概述,并对靶向cGAS-STING的抗炎症抗衰老药物进行了展望(见综述Box 2)。
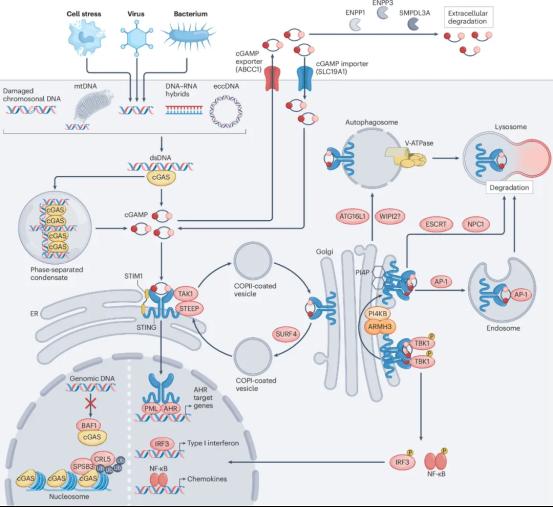
图2. cGAS-STING信号通路的调控
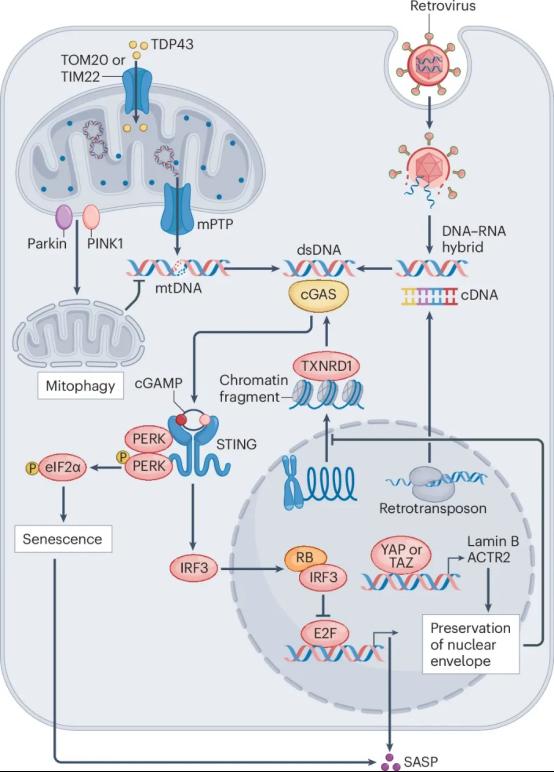
图3. cGAS-STING信号通路介导的炎症及衰老
此外,cGAS-STING信号通路与癌症的发生发展密切相关,存在复杂的调控机制(图4)。文章阐述了通过靶向cGAS-STING信号通路的抗肿瘤免疫治疗的策略和机制,同时探讨了cGAS-STING介导的免疫抑制机制,从抗肿瘤和促进肿瘤两个方面对该领域的互作机制进行了系统性的讨论。抗肿瘤方面,除了经典的I型干扰素,作者还对一些STING的激动剂以及和其他疗法(如PD-1/PD-L1)的联合应用以及与适应性免疫在肿瘤中的关系进行了讨论;另一方面,文章对cGAS-STING介导的免疫抑制、免疫逃逸等进展也进行了讨论。
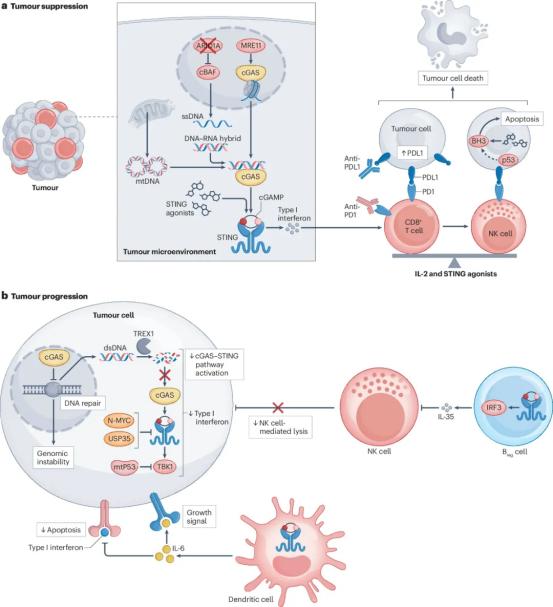
图4. cGAS-STING信号与肿瘤
最后,文章对未来新的研究方向和cGAS-STING领域未解决的重要问题进行了探讨。作者提出,系统深入地研究cGAS-STING信号通路的调控机制,以及它们与其他信号通路的互作,将提升我们对cGAS-STING信号通路复杂多样的功能和机制的理解,扩展其在抗感染、抗肿瘤以及抗衰老等领域的前景,进而帮助相关的疾病治疗方法在临床中进行应用。
致谢
张从刚为文章的通讯作者,药学院2021级博士生张正印为文章的第一作者。本研究得到国家自然科学基金委、北京市自然科学基金、生命科学联合中心、山西医科大学-清华大学前沿医学协同创新中心、北京生物结构前沿研究中心、清华大学自主科研笃实专项的共同资助。
重要参考文献
1. Vance RE. How DNA Sensing Drives Inflammation. N Engl J Med. 2024 Oct 17;391(15):1456-1458. doi: 10.1056/NEJMcibr2410049.
2. Flavell RA, Sefik E. Sensing DNA as danger: The discovery of cGAS. Immunity. 2024 Oct 8;57(10):2251-2254. doi: 10.1016/j.immuni.2024.09.009.
