细胞外蛋白(含分泌蛋白与跨膜蛋白)是多细胞生物生理调控的核心介质,其表达异常与癌症、神经退行性疾病等密切相关。利用邻近标记技术系统解析细胞外蛋白质组对疾病机制研究与靶向疗法开发具有重要意义,然而现有技术难以满足活体层面的研究需求。基于辣根过氧化物酶(HRP)的标记依赖细胞毒性过氧化氢(图1a),限制活体应用;BioID/TurboID等生物素连接酶因胞外ATP浓度不足导致标记效率受限,且内源性生物素产生背景干扰;光催化技术则受限于可见光穿透深度。
2025年3月15日,生命中心、清华大学药学院秦为课题组在Nature Communications杂志上发表了题为 “Spatiotemporally resolved mapping of extracellular proteomes via in vivo-compatible TyroID” 的研究论文。该研究开发了一种无毒的邻近标记技术TyroID,实现了活体内细胞外蛋白质组的高时空分辨率解析,该技术成功应用于活体肿瘤异种移植模型HER2邻近蛋白动态解析、血浆蛋白代谢追踪及小鼠海马区特异性蛋白质组标记,解决了传统邻近标记技术在解析细胞外蛋白质组的活体兼容性问题。

TyroID 技术的核心是基于植物或细菌来源的酪氨酸酶(tyrosinase),其可以将生物正交的苯酚底物氧化为高反应活性的邻醌(o-quinone),特异性标记邻近蛋白中半胱氨酸、赖氨酸及组氨酸等亲核氨基酸(图1b)。与传统邻近标记技术相比,TyroID无需依赖过氧化氢或可见光等外源激活条件,仅需添加酚类底物即可完成原位标记。
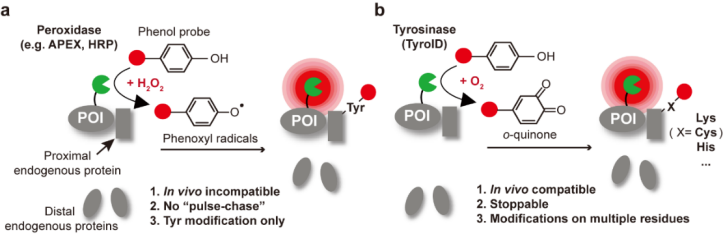
图1. (a)过氧化物酶(如 APEX 和 HRP)标记示意图;(b)TyroID标记示意图
该研究针对传统探针胞内渗透问题,开发膜非通透型探针"AxxP",实现乳腺癌细胞表面蛋白的特异性标记,且其修饰位点均位于胞外域,证明该技术具备解析跨膜蛋白拓扑结构的能力。该研究进一步将TyroID应用于HER2受体邻近蛋白研究,鉴定出多种新的HER2互作蛋白。最后,TyroID凭借其无毒、快速标记的优势,实现在活体内的应用:1)在活体肿瘤中精准解析HER2受体邻近网络,发现传统细胞实验无法捕获的互作蛋白;2)动态追踪血浆蛋白代谢规律,揭示载脂蛋白家族的高周转特性;3)实现脑区特异性蛋白的原位标记,为神经环路研究提供新工具。
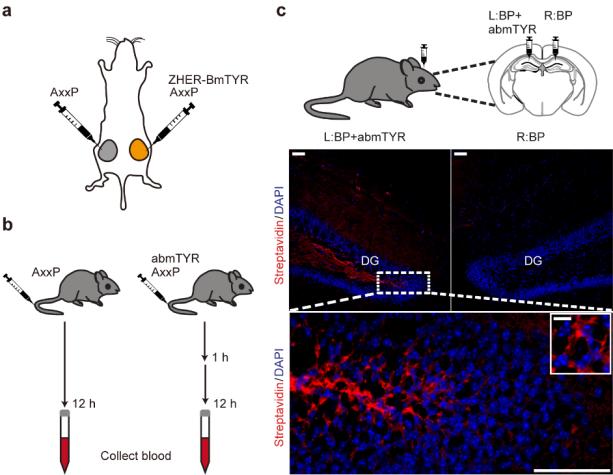
图2. TyroID在活体内的应用
综上,TyroID通过酶促生成邻醌实现无毒、快速的细胞外标记,为活体蛋白质组动态解析提供了创新工具。其在肿瘤微环境研究、血浆蛋白周转监测及神经生物学领域的应用,展现了广阔的研究潜力。
生命中心、清华大学药学院秦为助理教授为本文的通讯作者。中国科学院遗传与发育生物学研究所武照伐研究员为本文提供了重要实验帮助。清华大学药学院博士生张梓涓和博士后王妍坤为论文的第一作者。清华大学陆文捷, 中国科学院遗传与发育生物学研究所王晓飞博士, 清华大学博士生郭弘扬,博士后潘宣圳, 博士生刘泽瑜为本文提供了重要实验和数据分析帮助。北京大学陈兴教授课题组提供了细胞系支持。王初课题组的专职副研究员刘源博士、博士后肖伟弟博士(现为北京大学成都前沿交叉生物技术研究院研究员),以及王初教授提供了superTOP-ABPP实验的技术指导。秦为课题组得到了国家高层次海外人才计划,国家重点研发计划青年科学家项目,国家自然科学基金重大研究计划培育项目,面上项目,青年基金项目,中国博士后面上项目,生命科学联合中心,清华大学笃实计划,北京生物结构前沿研究中心,北京分子科学国家实验室基础研究基金,深圳市医学研究基金等基金支持。
原文链接:
https://www.nature.com/articles/s41467-025-57767-w
