2025年4月29日,生命中心、清华大学基础医学院向烨课题组在《自然-通讯》(Nature Communications)杂志在线发表了题为“Molecular mechanisms of the viral encoded chaperone 100K in capsid folding and assembly of adenovirus"(病毒编码分子伴侣100K在腺病毒衣壳折叠和组装中的分子机制)的研究论文,该论文研究通过冷冻电镜三维重构技术解析了腺病毒编码的伴侣分子100K与其未成熟衣壳蛋白hexon的复合物结构,揭示了一种病毒编码伴侣分子的作用机制。
腺病毒是一种可感染人类及多种动物的常见无囊膜双链DNA病毒,其衣壳直径约90纳米呈二十面体对称性1。腺病毒感染在临床上可引发多种疾病,例如发热性呼吸道疾病、咽结膜热、胃肠炎和腹泻等2,3。在免疫功能正常的个体中,腺病毒感染通常表现为无症状或轻微症状;而对免疫功能低下的人群,腺病毒感染可能发展为严重疾病4。截至目前,尚无专门针对腺病毒感染的获批治疗药物5。腺病毒衣壳主要由hexon蛋白三聚体组装而成,每个三聚体的结构可分为顶部和底部两个结构域6。其中,底部结构域具有拟六次对称性,由三个hexon单体的双果冻卷β桶结构构成7。Hexon蛋白的正确折叠和组装需要依赖病毒自身编码的100K蛋白的协助8。尽管100K蛋白的分子伴侣功能早在1982年就已被报道,但其发挥功能的分子机制,至今仍不清楚。
在本研究中,向烨团队利用两步亲和层析,成功捕捉到100K帮助hexon折叠的中间状态,并利用冷冻电镜技术解析了其近原子分辨率结构(图1)。腺病毒hexon与100K复合物由一个未成熟hexon三聚体和三个100K二聚体组装而成。100K二聚体环绕在hexon基部的双果冻卷结构域。在未成熟hexon三聚体中,每个hexon单体通过两个主要接触位点A和B被一个100K二聚体夹住,这两个主要接触位点分别位于双果冻卷结构域的内表面和外表面(图1);每个hexon单体同时通过其N端残基48-60与一个相邻的100K二聚体有接触(接触点C)(图1)。进一步的突变实验证实,破坏这些相互作用会导致hexon无法正确折叠与组装。100K通过三个关键接触位点(A、B、C)稳定未成熟的hexon构象,防止其过早聚集,并促进hexon三聚化。
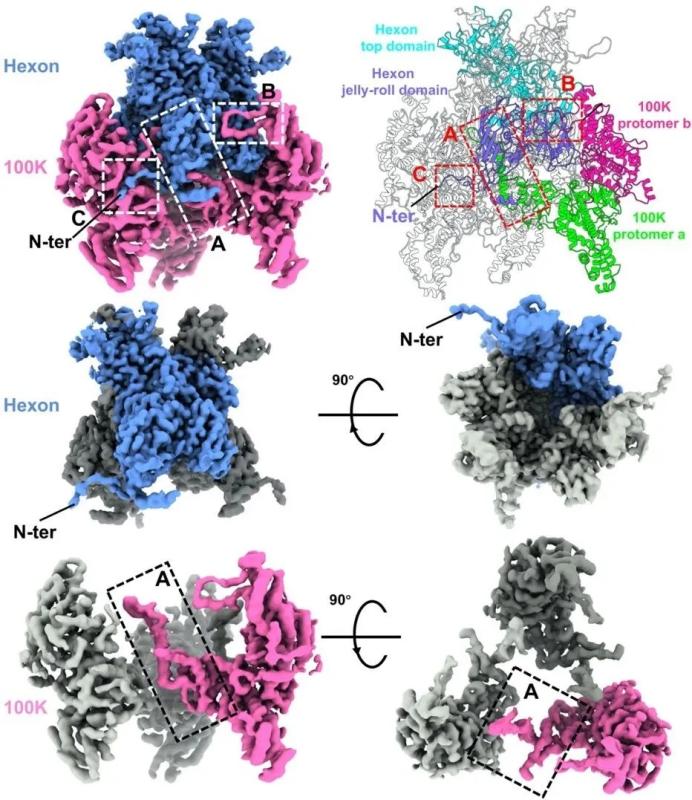
图1. 腺病毒未成熟hexon与100K复合物结构
基于此,向烨团队提出了100K辅助hexon三聚化的动态模型:100K在细胞质中主要以二聚体的形式存在。在核糖体合成hexon过程中,100K二聚体会立即与新生的hexon多肽相互作用。100K二聚体通过与hexon单体的N末端或者与hexo单体的双果冻卷结构域中的疏水部分互作,形成复合物。该初级100K二聚体-hexon单体复合物作为平台进一步募集100K及hexon单体,最终组装成未成熟的hexon(pre-mature hexon)。未成熟的hexon经历进一步的构象变化,释放结合的100K,从而形成稳定成熟的hexon三聚体(mature hexon)。本研究揭示了病毒编码分子伴侣的功能机制,为理解腺病毒的衣壳组装过程,以及靶向分子伴侣-衣壳蛋白互作界面的抗病毒药物研发提供了理论指导。
清华大学基础医学院长聘副教授,清华北大生命联合中心、北京生物结构前沿研究中心、山西医科大学-清华大学前沿医学研究中心研究员向烨与已出站博后刘琦博士为该论文的通讯作者,向烨课题组2019级直博生李海宁为该论文的第一作者。向烨课题组博士生邵鲁媛和刘哲为本研究提供了帮助。清华大学中国蛋白质科学中心(北京分中心)提供了设施支持。该项目研究获得山西医科大学-清华大学前沿医学研究中心,中国科学技术部,国家自然科学基金,清华北大生命科学联合中心,北京生物结构前沿研究中心的资助。
参考文献:
1.Arnold, A. & MacMahon, E. Adenovirus infections. Medicine 49, 790-793 (2021).
2. NAKAYAMA, M. et al. Pharyngoconjunctival fever caused by adenovirus type 11. The Pediatric Infectious Disease Journal 11, 6-8 (1992).
3. Filho, E. P. et al. Adenoviruses associated with acute gastroenteritis in hospitalized and community children up to 5 years old in Rio de Janeiro and Salvador, Brazil. Journal of Medical Microbiology 56, 313-319 (2007).
4. Lion, T. Adenovirus infections in immunocompetent and immunocompromised patients. Clin Microbiol Rev 27, 441-462 (2014).
5. Mukhopadhyay, R. et al. Adenovirus-Specific T Cells in Adults Are Frequent, Cross-Reactive to Common Childhood Adenovirus Infections and Boosted by Adenovirus-Vectored Vaccines. J Med Virol 97, e70222 (2025).
6. Burnett, R. M. The structure of the adenovirus capsid: II. The packing symmetry of hexon and its implications for viral architecture. Journal of Molecular Biology 185, 125-143 (1985).
7. Reddy, V. S., Natchiar, S. K., Stewart, P. L. & Nemerow, G. R. Crystal Structure of Human Adenovirus at 3.5 Å Resolution. Science 329, 1071-1075 (2010).
8. Cepko, C. L. & Sharp, P. A. Assembly of adenovirus major capsid protein is mediated by a nonvirion protein. Cell 31, 407-415 (1982).
原文链接:
https://www.nature.com/articles/s41467-025-59301-4
