2025年5月6日, 生命中心、清华大学基础医学院彭敏课题组和药学院李寅青课题组合作在《Journal of Experimental Medicine》杂志发表题为“BCOR and ZC3H12A suppress a core stemness program in exhausted CD8+ T cells”的研究论文,首次揭示了BCOR和ZC3H12A协同抑制CD8+ T细胞干细胞特性的分子机制,并鉴定出一组可逆转T细胞耗竭的关键因子。这一发现为开发新型免疫疗法提供了重要理论依据。

慢性病毒感染是人类健康的重大威胁之一。免疫系统在机体抗感染和抗肿瘤过程中发挥核心作用。在慢性病毒感染条件下,由于病毒不能被免疫系统彻底清除,病毒抗原的反复刺激导致CD8+T细胞进入一种功能异常(dysfunction)或耗竭(exhaustion)的状态。 耗竭T细胞(TEX细胞)表现为增殖和杀伤功能下降,伴随抑制性受体(如PD-1,LAG-3和TIM-3等)表达上调。尽管T细胞耗竭可防止免疫病理损伤,但也削弱了抗病毒免疫。前体耗竭T细胞(TPEX)是维持T细胞应答的关键,具有自我更新能力,可分化产生TCF1-耗竭T细胞(TEX)。TCF1在TPEX生成和维持中不可或缺,但其过表达仅能轻微增加TPEX数量,表明TCF1不足以完全调控TPEX。因此,能够促进TPEX分化以逆转T细胞耗竭的因子仍有待发现。此外,逆转T细胞耗竭长期困境在于TPEX的干性与TEX细胞的功能性不可兼得。增强TEX效应功能的策略(如PD-1阻断)往往由于TPEX的过度消耗而效果短暂;相反,增加TPEX的调控因子(如TCF1、TOX和MYB)通常会限制TEX的效应功能。因此,深入理解TPEX的生物学特性,尤其是鉴定能强力调控TPEX分化和维持的因子,对于设计逆转T细胞耗竭、应对慢性感染和癌症的策略至关重要。
研究团队利用慢性LCMV感染模型,发现表观遗传调控因子BCOR和RNA结合蛋白ZC3H12A协同抑制了TPEX的产生。敲除这两个基因的耗竭T细胞(简称TBZEX)展现出显著的变化:其扩增能力提升数百倍,且能持续清除病毒。这一特性突破了逆转T细胞耗竭的长期困境。进一步研究表明, TBZEX细胞激活了一个未知的核心干性程序。其与调控T细胞干性的其他关键因子(如TCF1和MYB)不同:TCF1和MYB这些因子既能促进急性感染中的记忆T细胞(TMEM)分化,也能促进慢性感染中的TPEX分化;而BCOR与ZC3H12A的缺失选择性地促进了TPEX而非TMEM的分化。此外,增强TPEX的因子(如TCF1、MYB和TOX通常加剧耗竭并削弱TEX的效应功能。相反,BCOR与ZC3H12A的缺失不仅促进TPEX分化,还缓解了耗竭,维持了TEX 的功能。
BCOR与ZC3H12A缺失的TPEX(TBZEX)中诱导的核心干性程序以约216个基因的高表达为特征。令人意外的是,其中仅15个(<10%)基因已知与TPEX相关,包括Tcf7、Sell、Batf、Slamf6、Lef1、Socs1等。与TCF1在TPEX中的重要作用一致,TCF1也是该核心干性程序所必需的,其缺失几乎完全阻断了TBZEX的诱导。除TCF1外,该研究还验证了一组此前未被重视的因子(包括PDZK1IP1、IFIT3、PIM2、LTB和POU2F2)对该程序的关键作用。其中,转录因子POU2F2(一种T细胞中罕有研究的转录因子)的表现尤为突出,在T细胞耗竭中起关键作用。过表达POU2F2可独立驱动TPEX扩增,显著降低病毒载量。
综上,该研究揭示了TPEX中一个受BCOR和ZC3H12A抑制的核心干性程序。解除该程序的抑制可强力增强TPEX功能,为缓解和逆转慢性病毒感染中的T细胞耗竭提供了多个新靶点。
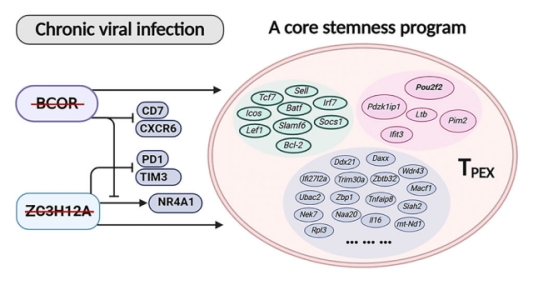
TBZEX核心干性调控程序工作机制模型
生命中心、清华大学基础医学院副教授彭敏、清华大学药学院副教授李寅青为该论文共同通讯作者,清华大学基础医学院已毕业博士生许靖、药学院博士生贾泽然和基础医学院博士后赵小翠为该论文共同第一作者。基础医学院博士后王丽霞和金刚也为该研究做出了重要贡献。此项研究得到了以下项目的资助:国家自然科学基金、北京自然科学基金、清华大学“笃实”计划、生命科学中心、山西医科大学-清华大学医学院前沿医学协同创新中心、清华免疫学研究所、清华IDG麦戈文脑研究中心、分子肿瘤全国重点实验室、过敏性疾病免疫机制与新药研发北京市重点实验室。
原文链接:
https://rupress.org/jem/article-pdf/222/8/e20241133/1944274/jem_20241133.pdf
