小RNA通过调节靶标基因表达,在植物生长发育和胁迫响应过程中发挥重要调控功能。玉米和水稻等禾本科植物花药中存在一类长度为21个核苷酸的相位siRNA(21-nt phasiRNA),它们在雄性生殖细胞发育和植物育性调控中发挥重要作用,其功能的异常可导致光/温敏雄性不育(1,2)。戚益军课题组和其他实验室之前发现,水稻中的21-nt phasiRNA可靶向数百个靶标基因,通过切割mRNA的方式调节基因表达(3,4)。玉米中的21-nt phasiRNA一直被人认为没有靶标基因,其作用机制长期未知。
2025年6月12日,清华大学生命科学学院、植物生物学研究中心戚益军课题组在《美国国家科学院院刊》(PNAS)在线发表题为“玉米花药中21-nt phasiRNA对靶标mRNA切割的时空调控”(Spatiotemporal regulation of target mRNA cleavage by 21-nt phasiRNAs in maize anthers)的研究论文。该研究利用降解组测序,对玉米多个发育阶段的花药及雄性生殖细胞进行了RNA末端分析,发现21-nt phasiRNA可切割数百个mRNA靶标,并发现21-nt phasiRNA介导的mRNA切割具有发育时期特异性和细胞类型依赖性。有意思的是,虽然21-nt phasiRNA在玉米和水稻中有相同的作用机制和功能,但21-nt phasiRNA及其靶标序列几乎没有保守性。
在该研究中,戚益军课题组收集了减数分裂前期、减数分裂I早前期和四分体/小孢子期的玉米花药,并用显微摄取的方法分离了处于减数分裂I早前期、四分体时期和小孢子时期的雄性生殖细胞(图1)。通过低起始量小RNA测序,在这些样品中系统鉴定了上万个21-nt phasiRNA。他们接着采用低起始量降解组测序检测了21-nt phasiRNA可能介导的mRNA切割信号。结果显示,在减数分裂前期、减数分裂I早前期和四分体/小孢子期的花药中,21-nt phasiRNA分别切割132、132和119个靶标mRNA;而在减数分裂I早前期的雄性生殖细胞、四分体和小孢子中,21-nt phasiRNA分别切割246、181和143个靶标mRNA,表明玉米中的21-nt phasiRNA可通过切割mRNA,调节基因表达。
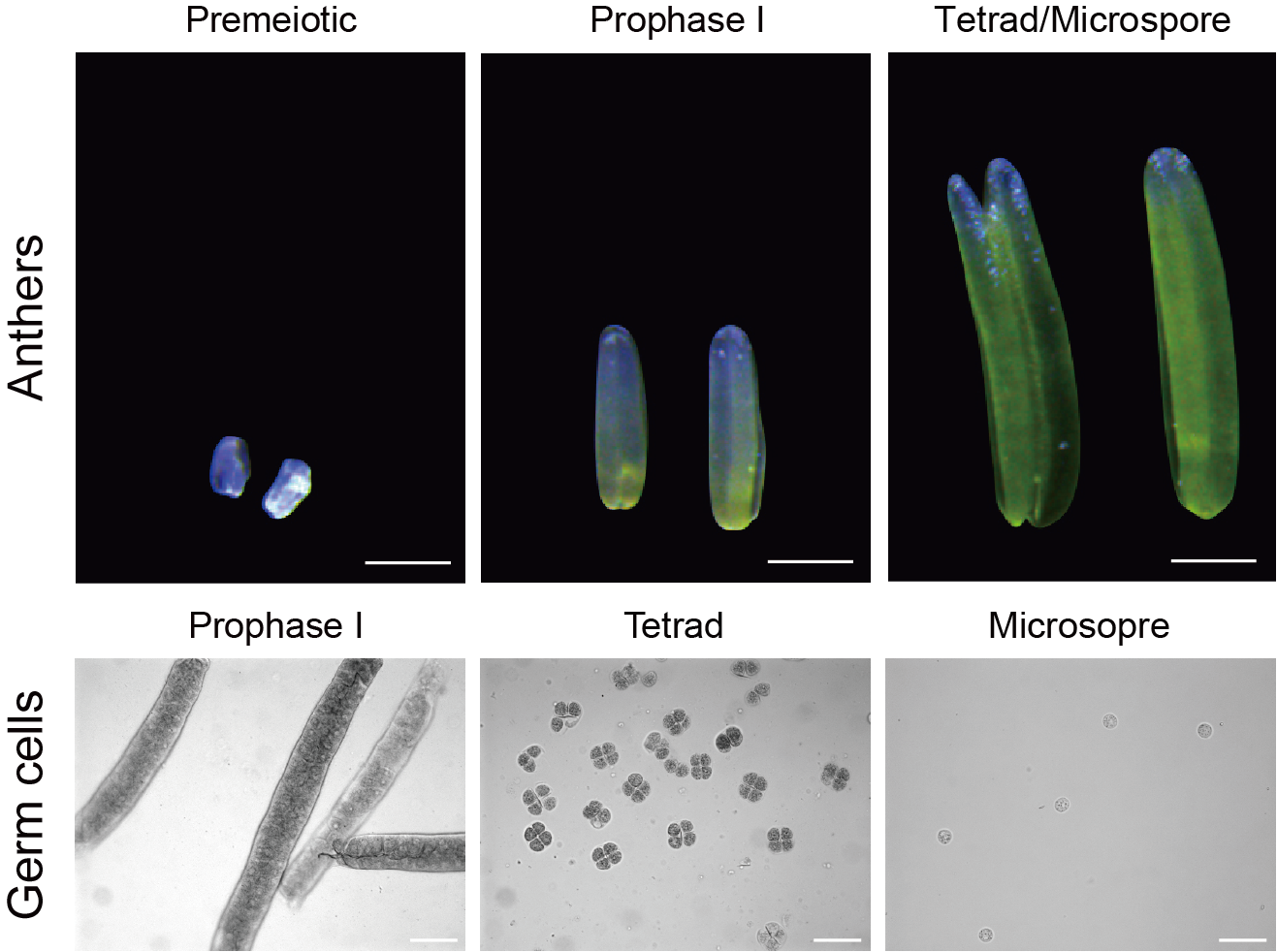
图1. 不同发育时期的玉米花药和雄性生殖细胞
进一步研究发现,21-nt phasiRNA介导的mRNA切割信号在花药与雄性生殖细胞发育不同阶段呈现动态变化(图2),说明其对靶标mRNA的调控具有发育时期特异性。在处于同一发育阶段的花药和雄性生殖细胞中,部分21-nt phasiRNA具有花药壁体细胞或雄性生殖细胞特异的靶标基因(图3),并且这些靶标基因分别与花药壁体细胞和雄性生殖细胞的特定生物学功能相关联,表明21-nt phasiRNA在花药的不同细胞类群中发挥不同功能。戚益军课题组之前研究发现,小RNA 5'末端核苷酸决定其与效应AGO蛋白结合的特异性(5)。分析显示,仅在雄性生殖细胞中有靶标的21-nt phasiRNA,其5'末端有非常强的胞嘧啶(C)偏好性,在花药壁体细胞和雄性生殖细胞中均有靶标的21-nt phasiRNA,偏好性并不明显,而仅在花药壁体细胞中有靶标的21-nt phasiRNA,这种偏好性则进一步减弱。这些结果表明,在花药的不同细胞类群中,存在不同的21-nt phasiRNA群体,它们与不同AGO蛋白结合,特异性地调控不同靶标基因。
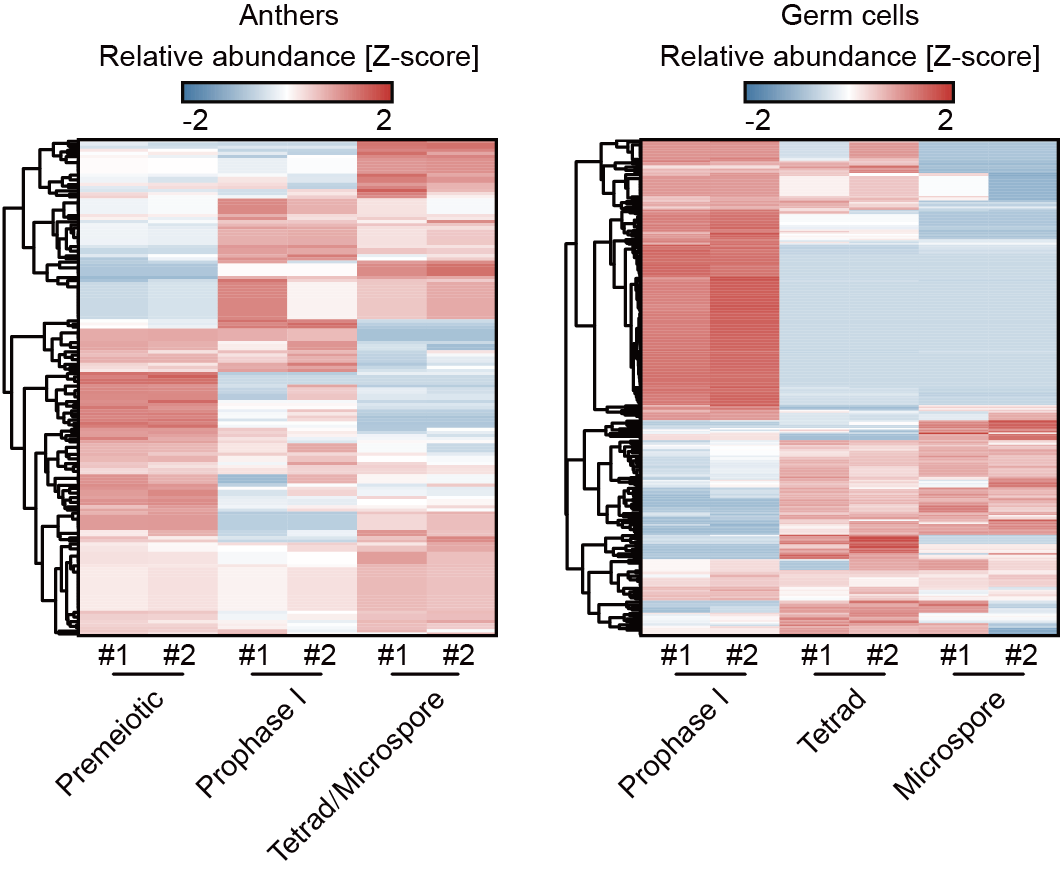
图2. 玉米不同发育时期21-nt phasiRNA对靶标mRNA的切割
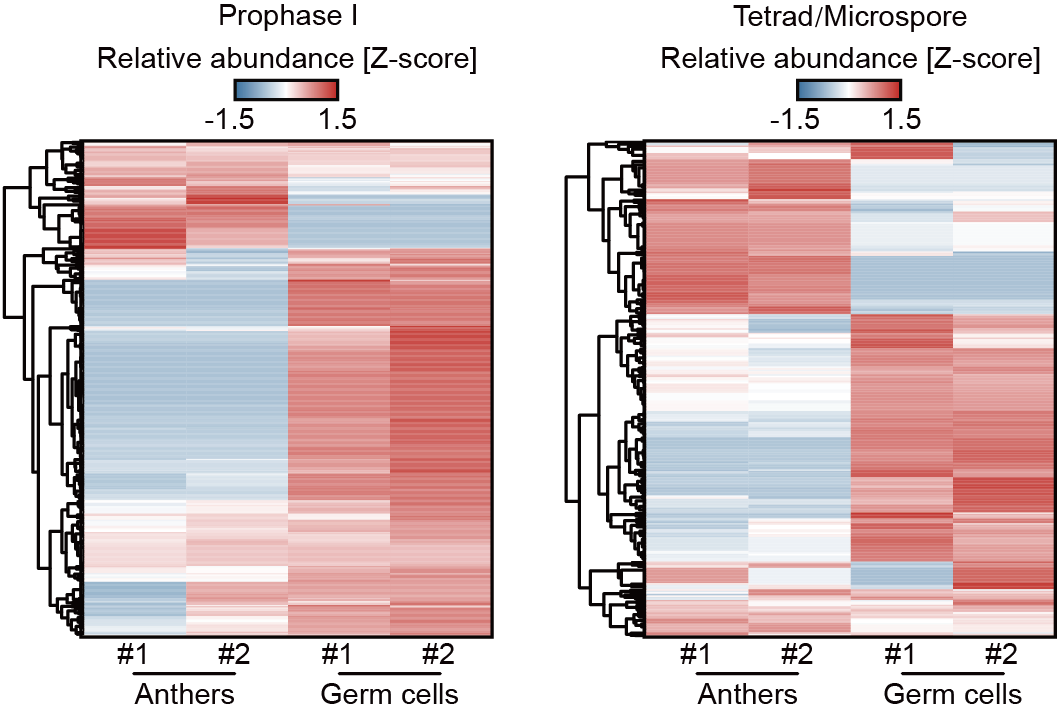
图3. 玉米花药和雄性生殖细胞中21-nt phasiRNA对靶标mRNA的切割
最后,对玉米和水稻中21-nt phasiRNA及其靶标的演化分析表明,21-nt phasiRNA的产生位点具有保守的基因组位置,但它们的序列完全不同,并且它们靶向的基因也不相同。这表明phasiRNA及其对靶标的调控在禾本科植物中已发生快速分化。
综上所述,该研究系统鉴定了玉米花药和雄性生殖细胞各发育阶段的21-nt phasiRNA及其切割靶标,并揭示了玉米中21-nt phasiRNA调控靶标基因的时空特异性,为研究禾本科植物21-nt phasiRNA在雄性育性调控中的功能奠定了必不可少的基础。非常值得进一步研究的是,21-nt phasiRNA是作为一个群体共同作用调控雄性育性,还是仅有少数核心21-nt phasiRNA负责这种调控。
戚益军教授和博士后连璧为该论文的共同通讯作者,博士后连璧和博士生黄天笑为共同第一作者,安徽农业大学生命学院姜鹏飞教授和中国农业大学农学院黄伟博士、金危危教授参与了部分工作。该研究由国家自然科学基金委和新基石基金会提供经费支持。
论文链接:https://www.pnas.org/doi/epub/10.1073/pnas.2422647122
参考文献:
1. Zhai, J., Zhang, H., Arikit, S., Huang, K., Nan, G.L., Walbot, V., and Meyers, B.C. (2015). Spatiotemporally dynamic, cell-type-dependent premeiotic and meiotic phasiRNAs in maize anthers. Proc Natl Acad Sci U S A 112, 3146-3151.
2. Fan, Y., Yang, J., Mathioni, S.M., Yu, J., Shen, J., Yang, X., Wang, L., Zhang, Q., Cai, Z., Xu, C., Li, X., Xiao, J., Meyers, B.C., and Zhang, Q. (2016). PMS1T, producing phased small-interfering RNAs, regulates photoperiod-sensitive male sterility in rice. Proc Natl Acad Sci U S A 113, 15144-15149.
3. Jiang, P., Lian, B., Liu, C., Fu, Z., Shen, Y., Cheng, Z., and Qi, Y. (2020). 21-nt phasiRNAs direct target mRNA cleavage in rice male germ cells. Nat Commun 11, 5191.
4. Zhang, Y., Lei, M., Zhou, Y., Yang, Y., Lian, J., Yu, Y., Feng, Y., Zhou, K., He, R., He, H., Zhang, Z., Yang, J., and Chen, Y. (2020). Reproductive phasiRNAs regulate reprogramming of gene expression and meiotic progression in rice. Nat Commun 11, 6031.
5. Mi, S., Cai, T., Hu, Y., Chen, Y., Hodges, E., Ni, F., Wu, L., Li, S., Zhou, H., Long, C., Chen, S., Hannon, G.J., and Qi, Y. (2008). Sorting of small RNAs into Arabidopsis argonaute complexes is directed by the 5' terminal nucleotide. Cell 133, 116-127.
