还记得期末考试前的疯狂复习吗?那些熬夜背下的公式、概念,仿佛刻进了脑子里。可考完试才一周,有些细节就开始模糊;一年后再回顾,可能只剩个大概轮廓。这种“学得快,忘得也快”的经历,相信在我们的学生时代可能都有过。随着时间推移,记忆悄然“丢失”的现象是我们每个人都经历过的一种自然遗忘(natural forgetting)。它看似是大脑的“不足”,但其实是大脑一项至关重要的生存策略!想象一下,如果所有琐碎信息——例如:昨天早餐吃了什么、三年前随手刷到的新闻标题——都牢牢占据脑海,我们的大脑将难以聚焦于真正重要或当下的信息,进而导致决策失误。因此,适度的遗忘,让我们的大脑保持灵活,更好地适应动态的环境变化。
2025年6月12日,生命中心、清华大学生命科学学院、清华大学-IDG/麦戈文脑科学研究院钟毅课题组与中山大学医学院李乾团队联合在《当代生物学》Current Biology杂志在线发表了题为“记忆在不同突触集群间的快速转移促进果蝇的遗忘”Rapid memory shift between different synaptic ensembles promotes forgetting in Drosophila的文章,发现果蝇记忆痕迹是通过突触层面的“先转移后消失“来介导记忆遗忘,并且进一步解析了该过程依赖于突触前活性区(AZs)数目“先增加后下降”的结构变化及其中的分子机制,为理解记忆主动遗忘机制提供了新视角。

长久以来,我们对遗忘的理解是,遗忘就像用橡皮擦慢慢擦掉铅笔字迹一样——记忆“痕迹”在大脑神经连接中逐渐变淡、减弱。这种“记忆衰减论”非常直观,符合我们的日常感受:时间越久,记忆越模糊。2010年,钟毅课题组利用果蝇模型首次发现,记忆的自然遗忘是一个主动发生的过程,该过程由Rac1分子通过调控神经元细胞骨架来实现(Shuai, et al., Cell, 2010; Gao, et al., PNAS, 2019)。随着研究的深入,科学家们揭示了遗忘可能涉及多种复杂的分子与细胞机制,例如:突触连接的弱化,如AMPA受体的内吞作用(Migues, et al., J Neurosci, 2016; Awasthi, et al., Science, 2019);神经调质信号的改变,如多巴胺信号通路(Berry, et al., Neuron, 2012; Berry et al., Cell, 2015; Sabandal, et al., Nature, 2021);神经环路的重塑,如新生神经元整合(Akers, et al., Science, 2014; Epp, et al. Nat Commun, 2016; Gao, et al., J Neurosci, 2018);以及胶质细胞的清除作用,如小胶质细胞介导的突触吞噬(Wang, et al., Science, 2020)。然而,这些研究大多聚焦于特定的分子或细胞事件,对于自然遗忘过程在时间和空间上的整体动态演变——特别是在记忆最初编码的突触层面,这一过程是如何发生并最终导致记忆消退的——仍缺乏系统性的观测。此外,在主动遗忘框架内,Rac1调控神经元细胞骨架变化,如何进一步驱动下游突触和神经环路的改变,最终实现记忆的主动清除,其作用机制仍是一个未解的“黑箱”。
在最新发表的研究中,研究者们创新性地利用双光子活体成像技术,首次实现了对自然遗忘过程的实时动态观测。这一发现挑战了传统观点——自然遗忘并非简单的记忆“擦除”或“痕迹减弱”。相反,研究揭示,遗忘更像是大脑内部一场精密有序的“信息库搬迁与重组工程”。通过综合运用遗传学、行为学、免疫荧光标记和活体成像等多种方法,研究者们深入探究了果蝇嗅觉惩罚性记忆的自然遗忘过程。他们发现,在突触记忆痕迹层面和记忆提取环路上,都会发生记忆转移现象:从最初形成记忆的γKCs神经元轴突的γ1区域,迁移到临近的γ4区域,并在γ4区域最终实现遗忘。如果阻止记忆的转移,最初的记忆痕迹则可以长期稳定存在,记忆也不会被遗忘。此外,这种记忆转移现象与突触前活性区“先增加后下降”的结构性变化密切相关。基于此,研究者们获得了对遗忘过程的新理解(如下图所示):学习首先激活Rac1/Dia信号通路,通过重塑神经元细胞骨架介导突触结构的数目增加,从而启动了记忆向γ4区域的转移;随后,Ephrin信号通路激活,导致突触结构的数目下降,促使转移后的记忆消退,最终完成遗忘过程。
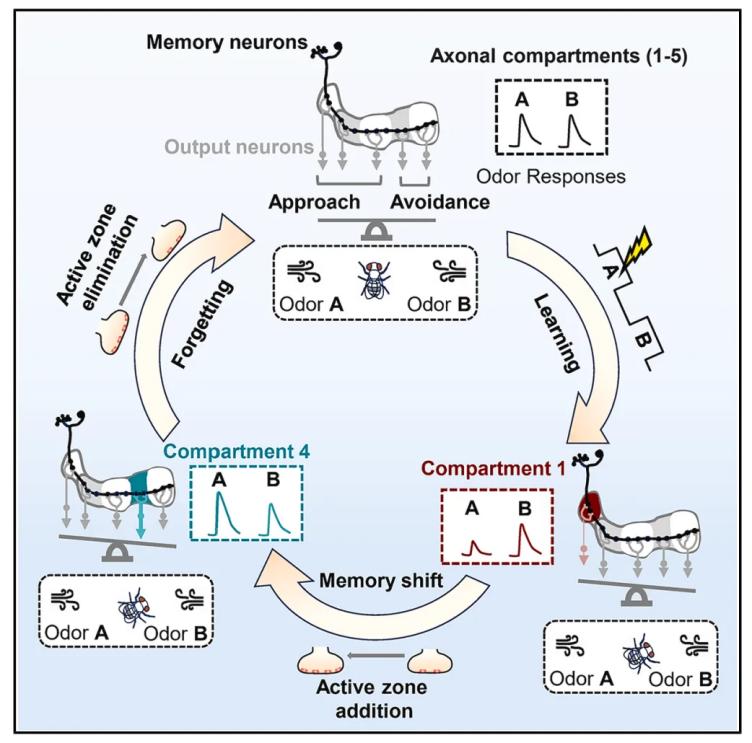
果蝇短期记忆通过“先转移后消失”介导遗忘的示意图
这些关于遗忘机制的新理解,其意义可能远超果蝇的学习记忆系统。钟毅课题组的先前研究表明,Rac1通路介导的主动遗忘机制同样存在于哺乳动物中(Liu, et al., Current Biology, 2016; Liu, et al., Cell Reports, 2018; Lv, et al., Nature Communications, 2019; Lei, et al., PNAS, 2022)。该机制不仅与人类的阿尔茨海默症(AD)(Wu, et al., Protein Cell, 2019)和自闭症(autism)(Dong, et al., PNAS, 2016)等疾病密切相关,还可能与衰老性健忘(Mo, et al., Aging Cell, 2022)和成瘾记忆消退(Yang, et al., Current Biology, 2023)存在潜在联系。更重要的是,此项研究不仅深化了我们对Rac1通路介导记忆主动遗忘的生物机制的理解,也为提升人工智能的持续学习能力提供了新思想(Wang, et al., Nature Machine Intelligence, 2023)。因此,基于这些突破的遗忘机理研究,未来有望推动生物启发的人工智能创新。
生命中心、清华大学生命科学学院、清华-IDG/麦戈文脑科学研究院钟毅教授与中山大学医学院李乾副教授是此工作的共同通讯作者。清华大学2019级在读博士生黄宁,2021级在读博士生周骏,已出站博士后高扬(现任山东师范大学讲师)和2018级在读博士生彭榆玮是此工作的共同第一作者。清华大学已出站博士后胡皖桐和清华大学生命科学学院、清华-IDG/麦戈文脑科学研究院欧光朔教授为本文的共同作者。本研究得到了科技创新2030-“脑科学与类脑研究”重大项目(STI2030-Major Projects,2022ZD0204900)、国家自然科学基金委创新群体项目(32021002)和面上项目(31970955)、山东省自然科学基金项目(ZR2023QC194)以及清华-北大联合中心的经费资助。本研究特别感谢以下单位提供的果蝇品系:北京大学李毓龙教授课题组、美国Scripps研究所Davis教授课题组、北京大学罗冬根教授课题组、东南大学潘玉峰教授课题组、美国Bloomington果蝇保种中心和清华大学果蝇保种中心;同时感谢北京智源人工智能研究院雷博研究员的宝贵建议。
原文链接:https://www.cell.com/current-biology/fulltext/S0960-9822(25)00663-3
