2025年6月11日,生命中心、清华大学生命科学学院欧光朔课题组在《eLife》杂志上发表了题为"驱动蛋白-2自抑制依赖肘部磷酸化"(Kinesin-2 autoinhibition requires elbow phosphorylation)的研究论文。该研究通过体外磷酸化分析、分子动力学模拟、单分子成像与遗传筛选等技术,首次揭示NIMA家族激酶NEKL-3通过磷酸化驱动蛋白-2家族成员KIF17/OSM-3的保守"肘部"结构域,实现对纤毛内运输(IFT)的精确时空调控。核心发现:
欧光朔实验室通过体外磷酸化以及质谱发现NEKL-3激酶直接磷酸化驱动蛋白OSM-3 C端部区,并鉴定了被磷酸化的YSTT基序。结构预测构显示,该基序位于连接两个卷曲螺旋的柔性铰链区——此区域在驱动蛋白超家族中被类比为"肘部",但其具体功能此前并未被报道。
研究团队进一步通过构建磷酸化缺失和磷酸化模拟的线虫突变体发现,磷酸化缺失蛋白持续活化,在神经元轴突异常聚集并产生纤毛缺陷;磷酸化模拟蛋白可进入纤毛但运动活性受损,纤毛长度与IFT速度显著降低。表明磷酸化诱导OSM-3形成自抑制状态,阻止其在胞质运输中的提前激活,确保驱动蛋白复合物在纤毛基部被适时激活。
能量最小化模型显示,在磷酸化模拟突变体中,尾部结构域与马达头部结合形成反向β折叠,维持自抑制构象;磷酸化缺失突变则引发头部-尾部解离,导致持续性激活。生化实验进一步证实:磷酸化缺失突变使ATP酶活性异常升高,微管滑行速度显著加快。
通过大规模遗传筛选,发现磷酸化缺失突变体的抑制子A489T可完全恢复纤毛定位与IFT速度。表明该位点需经历动态磷酸化循环以精确调控活性。
该研究首次阐明"肘部磷酸化" 作为驱动蛋白自抑制的关键分子开关:NEKL-3介导的磷酸化在胞质运输阶段抑制OSM-3活性,到达纤毛基部后去磷酸化激活其运动功能。这种时空调控机制确保IFT货物高效递送,为理解纤毛相关疾病提供新视角。
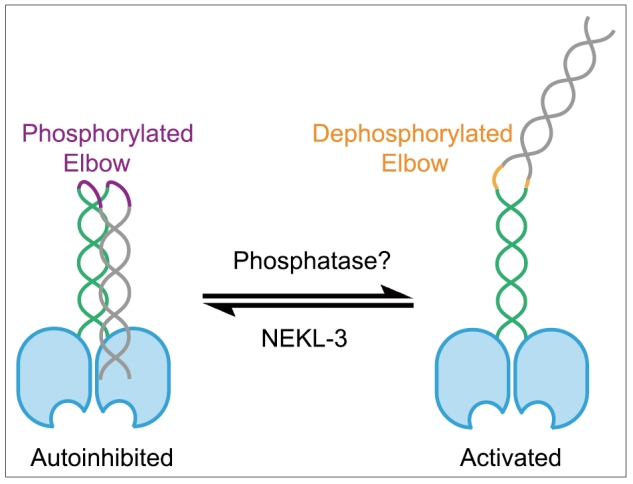
图1. OSM-3 的肘部被 NEKL-3 磷酸化后,呈现自抑制状态;而去磷酸化后,由于肘部构象变化,OSM-3 从折叠的自抑制状态转变为开放的激活状态。
生命中心、清华大学生命科学学院欧光朔教授为本论文的通讯作者,清华大学生命科学学院2020级博士生陈广涵为第一作者,清华大学生命科学学院2023级博士生郭正阳参与了部分工作。该研究工作得到了清华大学蛋白质化学与组学平台的技术支持,以及清华-北大生命科学联合中心、北京生物结构前沿研究中心以及国家自然科学基金提供经费支持。
原文链接:https://doi.org/10.7554/eLife.103648
