“成胶促免疫,天然去雕饰;聚散皆清净,强效护机体”
在应对新发传染病威胁时,亚单位疫苗因其卓越的安全性备受关注,然而其免疫原性不足的问题亟待解决。目前,传统铝盐佐剂仍是全球使用最广泛的疫苗佐剂,但其存在 免疫效果有限和可能引发局部不良反应等局限性。开发靶向特定固有免疫信号通路激动剂成为当前的有效策略,但这些候选激动剂常常需要额外的化学修饰或者偶联到特定载体上来增强其佐剂作用。这些额外步骤不仅增加了成本,还容易引起副作用:如CpG寡核苷酸通常需进行硫代修饰以抵抗降解,这些修饰可能导致抗CpG抗体、流感样症状甚至细胞因子风暴等副作用,并增加诱发自身免疫反应的风险。因此,开发兼具安全、高效与简便的亚单位疫苗新型佐剂平台,已成为疫苗领域迫在眉睫的研究重点。
2025年7月8日,生命中心、清华大学生命学院/免疫学研究所刘万里团队(免疫学),清华大学/香港理工大学刘冬生团队(化学/材料)、国家纳米科学中心杨雨荷团队(纳米/结构)、中国医学科学院医学实验动物研究所刘江宁团队(实验动物与感染模型)等国内一系列的交叉学科力量深度协同,在生物医学工程领域的国际顶级学术期刊Nature Biomedical Engineering联合发表题为《Enantiomer-dependent and modification-free DNA matrix as an adjuvant for subunit vaccines against SARS-CoV-2 or pneumococcal infections》研究论文。

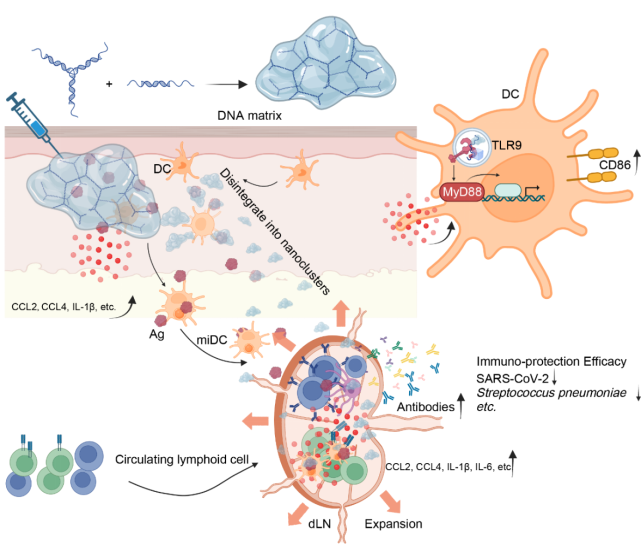
该交叉学科研究创新性的构建了一种「无修饰的右手螺旋型DNA基质胶」一体化的佐剂平台:仅由五条天然短链 DNA 单链自组装而成,既无需任何化学改造,又具备动态胶体特性,可在注射部位持续缓释,并高效引流至淋巴结靶向富集DNA组分和抗原组分。该DNA基质胶依赖树突细胞中的TLR9-MyD88信号通路激活天然免疫,进而显著增强抗原特异性体液免疫应答和中和抗体产生,实现对SARS-CoV-2和肺炎链球菌感染的强效保护。尤为重要的是,该佐剂的活性严格依赖于DNA链的右手螺旋(D型)手性,避免了化学修饰带来的安全风险,为下一代安全、高效的亚单位疫苗开发提供了全新思路。
交叉学科攻关团队证明了DNA基质胶是一种安全高效的佐剂平台。该DNA基质胶仅由五条天然磷酸二酯骨架的DNA单链(无硫代修饰或碱基甲基化)自组装而成,生产过程简便,易于与不同类别的抗原组分混合免疫。在小鼠模型中,与模式抗原(OVA)或病原体抗原(SARS-CoV-2 Spike/RBD蛋白、肺炎球菌结合疫苗PCV13)联用,该佐剂诱导的抗原特异性IgG抗体滴度显著高于抗原单独免疫组,也显著高于金标准铝佐剂组。该佐剂能诱导快速、强劲且持久的抗体反应。在SARS-CoV-2 Spike蛋白免疫实验中,该佐剂单剂接种即可产生高滴度抗体(铝佐剂需两剂),抗体水平可持续100天以上;再次加强免疫能引发强烈的记忆反应。更重要的是,与硫代磷酸酯修饰的CpG ODN不同,这种无修饰的DNA基质胶不会诱导产生针对DNA基质成分或双链DNA(dsDNA)的自身反应性抗体,显著降低了潜在的自身免疫风险。局部不良反应(如足垫肿胀、疼痛)也远低于铝佐剂。
交叉学科攻关团队验证了DNA基质胶疫苗能诱导强大的预防保护效力。在SARS-CoV-2感染模型中,经DNA基质胶配伍的Spike蛋白疫苗免疫表达人ACE2受体的转基因小鼠(K18-hACE2)小鼠,攻毒后全部存活且无显著体重下降或临床症状,肺部病毒载量极低,仅显示轻微病理变化。相比之下,单独Spike免疫组小鼠全部死亡,Alum佐剂组存活率仅33%且出现明显病症。DNA基质胶组诱导的中和抗体(NT50)滴度是Alum组的20倍左右。在肺炎链球菌感染模型中, 用DNA基质胶配伍商用肺炎球菌疫苗PCV13免疫的小鼠获得完全保护(存活率100%),无败血症且体重稳定;而单独PCV13组小鼠全部死亡,Alum佐剂组存活率仅50%,且均出现明显体重下降和不同程度的菌血症。
交叉学科攻关团队综合利用多学科方法阐明了DNA基质胶发挥高效佐剂作用的机制。体内外研究表明,在注射部位,DNA基质胶的滞留时间显著延长(半衰期比可溶性DNA组分延长14倍),并能有效延长共递送抗原的滞留。在生理环境下,DNA基质胶会自发崩解成纳米簇。这种动态解体过程通过计算机动态模拟和物理表征技术(动态光散射DLS、透射电镜TEM)得到证实。自动崩解形成的DNA纳米簇显著提高了其被树突状细胞(DC)吞噬的效率,并促进其活化(上调CD86、细胞因子分泌)。不仅如此,这种动态特性促进了DNA组分的淋巴管靶向运输,使其在引流淋巴结(dLN),特别是在髓质区中高效富集,并与SIGNR1+细胞(髓质巨噬细胞和DC)高度共定位。
交叉学科攻关团队综合利用实验动物模型揭示DNA基质胶通过激活天然免疫反应,从而激活高效的体液免疫反应。该佐剂在注射部位(足垫)诱导产生强大且特异性的促炎细胞因子和趋化因子(如IL-1β, IL-6, CCL2, CCL4, CCL5),远强于Alum诱导的微弱且混杂的反应。在dLN中,该佐剂能快速(12小时内)诱导强烈的固有免疫反应发生,促进淋巴结显著扩张,募集大量B细胞、T细胞、DC和巨噬细胞,并强力激活DC。为强大的体液免疫应答奠定基础。在抗原存在下,该佐剂能有效促进dLN中生发中心(GC)B细胞、滤泡辅助性T细胞(Tfh)和浆细胞的形成,诱导强效体液免疫放映。
该交叉学科攻关团队综合利用遗传学、免疫学、生物物理学等多学科手段,通过多种基因敲除小鼠模型(包括ZBP1, AIM2, cGAS, STING, TRIF, TLR7, TLR9, MyD88等),发现DNA基质胶的佐剂活性严格依赖TLR9受体及其下游适配体蛋白MyD88,而与胞质DNA感知通路(cGAS-STING等)或TLR7无关。通过骨髓嵌合体实验和细胞特异性MyD88条件敲除小鼠实验证明,MyD88信号在骨髓来源的造血细胞(特别是树突状细胞DC)中至关重要,而在B细胞或角质形成细胞中则非必需。研究者通过体外刺激实验,生物膜干涉技术(BLI)以及免疫荧光共定位等实验证明了DNA基质胶与TLR9蛋白的直接相互作用。
最后,交叉学科攻关团队从生物化学的核心本质出发,揭示DNA基质胶发挥佐剂功能的手性依赖性和序列依赖性。得益于核酸化学平台的强大支撑,研究者精准构建了具有相同胶体特性的对映体DNA基质胶。免疫学研究平台的系统评估揭示利用天然D型DNA构建的D-DNA基质胶具有强免疫刺激活性,而利用其分子对映体L型DNA构建的L-DNA基质胶(具有相似的胶体特性和纳米簇形成能力)则几乎完全丧失活性。BLI实验进一步证实L-DNA基质无法有效结合TLR9蛋白。这种严格的手性依赖性凸显了天然D型DNA结构在TLR9识别中的关键作用。同样,借助化学平台对DNA序列的精确设计(如将关键CpG ODN相似序列替换为GC),结合免疫学功能测试,发现尽管原始DNA基质胶序列中意外含有多个CG序列,但将其关键CpG ODN相似序列替换为GC(GC-DNA基质)仍保留相当活性;只有将所有CG全部替换为GC才会显著削弱活性。这表明其激活能力不完全依赖特定CpG ODN基序,但仍然和CG数量相关。
综上所述,交叉学科攻关团队成功开发了一种基于无修饰的右手螺旋型DNA基质胶的新型佐剂平台。此一体化佐剂平台巧妙地结合了TLR9激动剂的内在免疫激活能力和纳米颗粒平台的靶向递送优势,通过独特的动态胶体特性实现长效滞留和淋巴靶向递送,并严格依赖TLR9-MyD88信号通路(主要在DC中)激活强有力的天然免疫,最终驱动高效持久的抗原特异性体液免疫和中和抗体产生,提供针对病毒和细菌病原体的卓越保护。其完全避免化学修饰的特性改善了现有佐剂的安全性问题,而严格的手性依赖性揭示了生物识别的精密本质。这项研究不仅深入阐释了DNA材料作为佐剂的作用机制,为理解免疫激活提供了新视角,更开辟了利用材料固有特性(动态性、手性)设计下一代安全高效疫苗佐剂的全新途径,具有重大的科学意义和广阔的临床应用前景。
本研究是交叉学科攻关团队协同合作的结晶,得益于多个团队的通力协作。清华大学生命学院/免疫学研究所刘万里教授(免疫学),清华大学/香港理工大学刘冬生教授(化学/材料)、国家纳米科学中心杨雨荷研究员(纳米/结构)、中国医学科学院医学实验动物研究所刘江宁研究员(实验动物与感染模型)为论文的共同通讯作者。来自交叉学科领域的多位国内培养成才的青年科研工作者,李翠峰博士、李雨欣博士、李桐博士生,周碧妮博士,魏孝辉博士为该论文共同第一作者。
本研究的交叉学科体系推动获得的实验结论和数据结果,充分体现“质本天然去雕饰,凝胶聚散成佐剂;精准富集善激活,清净长效护机体”的哲学本质(论文共同一作李雨欣博士原创诗作)。
该研究得到了国家科技部、国家自然科学基金、北京市自然科学基金、中科院战略性先导科技专项基金、清华大学春风基金、生命科学联合中心、清华大学免疫学研究所、清华大学万科公共卫生与健康学院等多项基金资助。
原文链接:https://www.nature.com/articles/s41551-025-01431-7
DNA基质胶一体化佐剂平台合作开发广告(短期有效):清华大学刘万里教授和刘冬生教授团队具备DNA水凝胶佐剂应用的知识产权和Pre-clinical研究体系,欢迎对此开展疫苗的后期开发合作(LiuLab@Tsinghua.Edu.Cn)
刘万里:清华大学生命学院博导和长聘终身教授,清华大学免疫学研究所、清华北大生命科学联合中心、膜生物学全国重点实验室、教育部蛋白质科学重点实验室、北京市慢性疾病免疫学重点实验室的研究员。获国家杰青、教育部长江学者特聘教授、科技部科技创新领军人才、国家高层次青年人才等支持。整合交叉学科平台对B淋巴细胞的免疫识别和免疫活化及相关疾病进行研究(发表Science、Cell、PNAS、Science Immunology、Immunity、Nature Immunology、Nature Biomedical Engineering、JCI、JEM x2、Cell Research x2、Protein Cell x2、Nature Communications x4、Science Advances、JCB、ARD、Leukemia)。获中国青年科技奖、华夏医学科技青年奖、药明康德生命化学杰出成就奖、谈家桢生命科学奖、树兰医学奖、霍英东教育基金会优秀青年教师奖等奖项。获基金委重点项目(x2)、专项项目(x2)、科技部重点研发计划(项目首席)支持。相关科研项目曾获中国十大医学科技新闻、教育部自然科学奖、中华医学科技奖、北京市医学科技奖等奖项。多次获邀在国内外学术会议做报告(中国免疫学年会、中国生物物理年会、美国细胞生物学会年会ASCB、美国免疫学年会AAI、美国风湿病年会ACR、国际免疫学联合会峰会IUIS,以及Keystone会议、EMBO会议、FASEB会议等)。入职清华大学以来共计培养博士研究生27人,其中已毕业18人(三名获得国家奖学金,多人获得校内奖学金),在读12人。指导毕业硕士8人;指导并训练博士后9人,其中已出站博士后5名,在站4名。
实验室发表的所有论文情况,请参见;实验室常年招聘博士后和技术员:
https://pubmed.ncbi.nlm.nih.gov/?term=wanli+liu%2C+tsinghua&sort=date
刘冬生: 1993年本科毕业于中国科学技术大学高分子化学专业,之后在中科院化学所从事高分子化学研究,其间攻读了在职硕士学位。1999年至2002年于香港理工大学学习,获博士学位后赴英国剑桥大学从事博士后研究。2005年2月入选中国科学院“百人计划”,加入国家纳米科学中心任研究员、博士生导师。2007年获得国家自然科学基金委员会“杰出青年基金”支持。2008年获得“第一届中国化学会~英国皇家化学会青年化学奖”; 2009年6月加入清华大学化学系,任教授、博士生导师。2011年获邀成为英国皇家化学会会士;2014年入选创新人才推进计划中青年科技创新领军人才计划,获得第七届中国化学会巴斯夫青年知识创新奖;2015年入选教育部长江学者特聘教授;2016年入选中组部“万人计划”领军人才。2020年成为中国化学会会士。2025年加入香港理工大学任高分子科学与化学生物学讲座教授。近年来先后担任了基金委重点项目、创新群体项目负责人,科技部重大基础研究专项项目(973项目)首席科学家。现任《European Polymer Journal》编辑、《高分子学报》、《高等学校化学学报》副主编,中国化学会高分子学科委员会秘书长。刘冬生教授长期致力于探索生命过程的高分子机制,以核酸及其嵌合高分子的合成与组装为基础,建立并命名了具有“中国标签”的原创性框架诱导组装新方法,揭示了细胞形状的稳定机制;制备了国际上首例全刚性分子网络的纯核酸超分子水凝胶,提出并证明了精确序列高分子链的“动力学互锁”机制,从分子层面系统解释了细胞外基质具有高通透性、动态与强度兼备的高分子本质;发展了单根高分子链折叠过程精确调控新方法,构建了系列快速运动的核酸分子马达与器件,为解析分子层面的能量转化提供了实验基础。共发表SCI论文180余篇,其中Acc. Chem. Res. 3篇、Angew. Chem. Int. Ed. 16篇、J. Am. Chem. Soc. 12篇、Adv. Mater. 6 篇,被引用11000余次;作为会议主席或共同主席组织了DNA24、系列核酸纳米技术国际研讨会(已举办十一届)等;受邀在全国高分子学术论文报告会、PPC17(环太平洋高分子大会)、ICOMF18(有序分子膜国际大会)等作大会报告。
杨雨荷:国家纳米科学中心研究员,课题组长,国家高层次人才(海外),国家重点研发计划首席科学家(青年)。本科毕业于清华大学化学系,后于美国亚利桑那州立大学化学系获博士学位。博士期间成功开发了以DNA纳米结构为模板的多酶体系,受到领域广泛关注。在斯克里普斯研究所(The Scripps Research Institute)博士后期间,在HIV和流感病毒的冷冻电镜结构解析方面取得突破性进展。相关研究工作发表在Nat. Nanotechnol.、Immunity、Cell Rep.、Nat. Commun.、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、J. Virol.等期刊。杨雨荷课题组致力于开发新一代DNA纳米疫苗,以及体液免疫分析平台技术,针对人类免疫缺陷病毒、冠状病毒以及流感病毒等,利用少量血清样品,高效、实时、全面捕获抗体表位信息,揭示疫苗效果及机理,详情见课题组网站yryanglab.com。课题组长期招聘助研(带编制),博士后以及科研助理,提供多学科交叉的纳米材料学和免疫生物学科研训练环境。欢迎广大免疫学、结构生物学、材料学等领域的人才加入。
刘江宁:微生物学博士,实验动物学研究员,中国医学科学院北京协和医学院医学实验动物研究所副所长,主要从事新发传染病动物模型研究及疫苗/药物有效性评价研究,兼任中国实验动物学会副理事长及秘书长、全国实验动物标准化技术委员会委员及秘书长。曾主持国自然青年项目、面上项目、专项项目和重大研究计划重点项目,以第一或通讯作者(含共同)在国内外学术期刊发表研究论文40余篇,曾获亚洲实验动物学会青年科技奖1项、教育部科技进步奖二等奖1项、全国科技系统抗击新型冠状病毒肺炎疫情先进个人荣誉称号。
