呕吐是一种复杂的生理保护反应,涉及消化系统、呼吸系统、神经系统和心血管系统的协同工作。它通常由毒性物质摄入、药物副作用或疾病(如周期性呕吐综合征,CVS)等因素触发。在临床医学中,呕吐是化疗、放疗以及术后恢复过程中最常见的副作用,影响了约17%-37%的患者。此外,超过三分之一的药物治疗因诱发呕吐而显著降低了疗效。尽管猫、狗和雪貂等哺乳动物模型在抗呕吐药物开发中发挥了重要作用,但这些动物模型上可用的遗传工具十分有限,而常用的实验动物小鼠却缺乏呕吐能力,这严重限制了呕吐机制研究的深入开展。
传统上,研究人员依赖药理学方法来探索呕吐的分子机制,但由于涉及多系统协作,这一方法难以解开复杂的神经环路和跨器官通信的奥秘。尤其是5-羟色胺(5-HT)受体在促进和抑制呕吐中的双重作用,以及周期性呕吐综合征的病因,至今仍是未解之谜。面对这些挑战,研究团队将目光投向了果蝇(Drosophila melanogaster),这一具有强大遗传操作工具的模式生物,以期通过其研究突破现有瓶颈。
2025年9月12日,生命中心、清华大学张伟课题组在 Science Advances 期刊上在线发表题为 《Molecular and neural basis of vomiting behavior in Drosophila melanogaster》 的研究论文。该研究首次发现黑腹果蝇具备呕吐能力,并通过遗传学与药理学手段,系统解析出一条完整的“从输入到输出”的呕吐调控环路。这一成果不仅填补了遗传动物模型的空白,也为人类呕吐相关疾病的研究与治疗提供了新的思路。
果蝇呕吐行为的发现
研究团队在实验中发现,果蝇在摄入黄连素(berberine)后会表现出类似呕吐的行为,这与猫和狗对黄连素的反应一致。黄连素是一种已知具有苦味和毒性的天然化合物,过去常用于果蝇味觉测试。实验中,研究人员将禁食一段时间的果蝇置于含黄连素溶液的玻璃管中,观察到果蝇会反复伸展唇瓣,随后将嗉囊中的食物通过唇瓣剧烈吐出。这一行为与其它昆虫常见的反刍(regurgitation)不同,反刍通常是将食物液滴吐到口器表面,用于浓缩或降温,而果蝇的表现则是将摄入液体几乎完全吐出,甚至能边走边吐,其剧烈程度和行为表现与人类的呕吐行为高度相似。进一步研究发现,这种现象并非小檗碱特有。当果蝇摄入砷、尼古丁等其他有害物质时,也会出现类似呕吐反应。这表明,果蝇的呕吐并非偶然现象,而是一种真正的防御性生理行为。

图1:自由活动的果蝇在进食小檗碱溶液后发生呕吐。
分子与神经机制的揭示
为阐明黄连素诱导呕吐的分子机制,研究团队聚焦于TrpA1,一种在哺乳动物和果蝇中均高度保守的化学感受器。TrpA1突变后,果蝇呕吐行为显著减少,表明TrpA1在呕吐中起重要作用。然而,现有研究显示黄连素无法直接激活TrpA1,提示其作用可能通过间接通路实现。进一步实验发现,敲除磷脂酶C(PLC)核心基因norpA的果蝇无法呕吐,支持了TrpA1可能通过GPCR和PLC通路被激活的假设。研究人员随后测试了多种GPCR激动剂,发现仅乙酰胆碱(ACh)和胆碱能显著诱导呕吐。由于黄连素可抑制胆碱酯酶,团队使用两种胆碱酯酶抑制剂进行验证,均观察到类似效果。此外,针对毒蕈碱型乙酰胆碱受体(mAChRs)的激动剂比烟碱型受体激动剂更有效,提示mAChRs在这一过程中起主导作用。双重突变实验进一步证实,TrpA1和mAChRs(特别是mAChR-B和mAChR-C)协同工作,而非平行通路。基于此,研究提出了黄连素通过mAChRs-PLC通路间接激活TrpA1的模型。
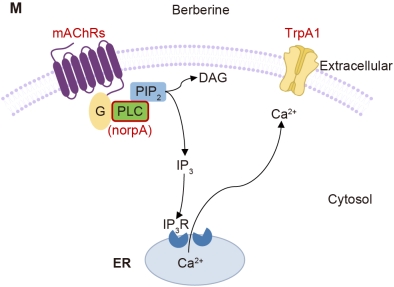
图2:小檗碱刺激前肠上皮细胞释放乙酰胆碱,间接激活TrpA1的分子通路示意图。
气管细胞的意外角色:跨器官通信枢纽
呕吐行为的调控涉及多个细胞类型。研究人员通过特异性敲低胆碱乙酰转移酶(ChAT)基因,发现前肠上皮细胞是ACh释放的主要来源。令人意外的是,ACh随后作用的关键细胞并非神经元,而是环绕在嗉囊导管末端及中肠前段的气管细胞。研究发现,当39166-GAL4 标记的气管细胞失活后,果蝇的呕吐反应显著减弱。
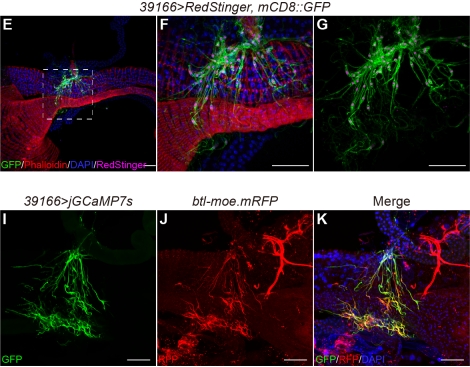
图3:39166-GAL4标记的气管细胞(btl标记)缠绕嗉囊导管末端和中肠前段。
气管细胞被激活后分泌速激肽(tachykinins, Tks),速激肽与哺乳动物中的 P 物质(Substance P)功能类似,已知与胃肠运动密切相关。它的作用是双重的:一方面,它直接促进内脏平滑肌(特别是前肠的P4泵)的强烈收缩;另一方面,它抑制大脑间体神经元释放一种名为抑肌肽(myosuppressin)的抑制性肽。通过同时促进收缩和解除抑制,速激肽有效地协同了呕吐的发生。这一发现不仅揭示了消化系统和呼吸系统在呕吐调节中的精巧协同,也为理解更广泛的跨器官交流机制提供了新的范例。
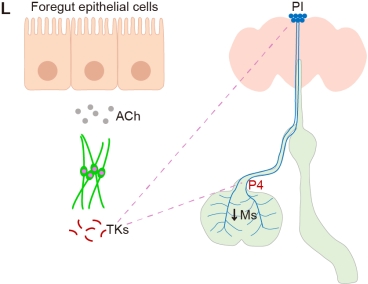
图4:气管细胞释放速激肽作用于P4泵和PI神经元的环路示意图。
与哺乳动物的保守性
有趣的是,研究还发现了果蝇呕吐调控中关键分子的保守性,包括NPF、NPFR、多巴胺受体和5-HT受体,这些分子在哺乳动物呕吐中也有类似功能。这一发现为研究5-HT受体在促进和抑制呕吐中的双重作用提供了新线索,并暗示果蝇模型可能有助于开发针对周期性呕吐综合征等疾病的治疗策略。
综上所述,该研究首次在果蝇中系统地建立了呕吐行为模型,并从分子、细胞和神经环路层面揭示了其完整机制。这项工作为理解呕吐的分子和细胞框架奠定了基础,并为探索循环性呕吐综合征等疾病的病理机制以及开发更安全、有效的止吐药物提供了宝贵的动物模型和潜在的治疗靶点。未来,该模型有望被用于大规模筛选能够调控呕吐的新型药物,并用于研究不同刺激(如晕动病、病原体感染或化疗药物)如何通过不同通路引发呕吐。
生命科学联合中心、清华大学生命学院、清华-IDG/麦戈文脑科学研究院、膜生物学全国重点实验室张伟副教授和博士后石琰琰(兼一作)是此项工作的共同通讯作者,已毕业博士生贾寅君对本研究亦有重要贡献。本研究得到了科技部2030-“脑科学与类脑研究”重大项目(2021ZD0203303)、国家自然基金委项目(31871059,32022029)以及生命科学联合中心优秀博士后基金的资助。
原文链接:https://www.science.org/doi/10.1126/sciadv.adv1143
