CRISPR-Cas系统是原核生物的获得性免疫系统,能够在CRISPR RNA的指导下特异性切割入侵的外源核酸。其中,分别以Cas9和Cas12为效应蛋白的type II类和V类CRISPR系统已成为当前基因组编辑的重要工具,广泛应用于基础研究、医学和农业等多个领域。已有研究表明,Cas12起源于IS200/605和IS607转座子家族编码的TnpB核酸酶。TnpB 蛋白广泛存在于细菌和古菌的转座子中,是原核生物中最庞大、最丰富的转座子相关核酸酶家族之一。TnpB和Cas12在种类和结构上具有高度多样性,从TnpB到Cas12的进化被认为是“多次独立起源”的转座子-免疫系统复杂进化事件。阐明CRISPR 系统从转座子起源的分子机制,是该领域长期悬而未解的科学难题。
2025年9月29日,中国科学院遗传与发育生物学研究所高彩霞团队、生命中心/清华大学生命科学学院刘俊杰团队、中国科学院动物研究所张勇团队合作,在Cell 期刊发表题为Functional RNA splitting drove the evolutionary emergence of type V CRISPR-Cas systems from transposons的研究论文(DOI: 10.1016/j.cell.2025.09.004)。研究团队历经7年深入探索,首次发现并定义了连接转座子与CRISPR之间长期缺失的关键进化中间体,命名为TranC (Transposon-CRISPR intermediate),弥合了CRISPR进化历程中的缺口。研究揭示,驱动TnpB转座酶向Cas12系统演化的核心机制源于引导RNA的“功能性分裂”,而非蛋白质结构的根本性改变。这一发现不仅破解了Cas12起源的分子机制之谜,也首次以实验证据阐明了RNA层面的创新如何驱动复杂分子机器的进化进程。
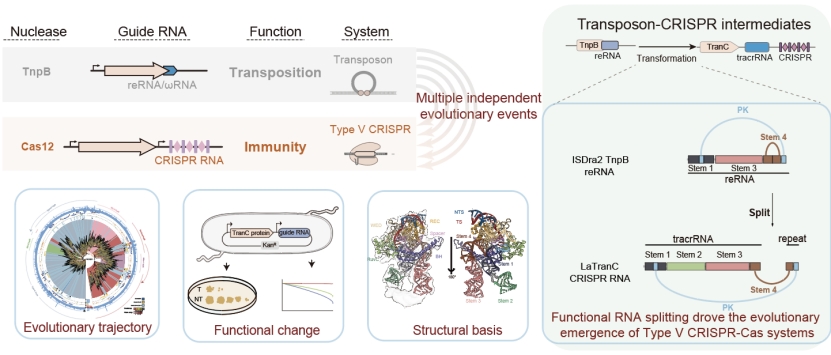
图:TranC系统的发现揭示了CRISPR起源的关键分子机制
研究团队首先结合序列相似性、共享结构域特征和保守催化基序三重搜索方法,从原核生物基因组与宏基因组数据中,鉴定出146个与TnpB亲缘关系较近的CRISPR偶联候选蛋白。通过系统发育分析、AlphaFold结构预测与功能元件对比,最终从中鉴定出6个演化中间家族,命名为TranC。这些TranC系统均与特定的TnpB分支构成姊妹群体,代表了TnpB向Cas12演化过程中的多个独立起源路径。其中,除此前已报道的Clade 8 (Cas12n,源自IS607家族)外,研究新鉴定的Clade 3、11、12、13、14源自IS605转座子家族,进一步描绘了Cas12系统多次“独立演化”的复杂场景。
功能实验证实,TranC系统具有独特的“双RNA导向机制”。在大肠杆菌体系中,来自多个支系的五个代表性TranC系统不仅能够使用自身编码的CRISPR RNA (tracrRNA + crRNA)进行靶向切割,还保留了祖先TnpB使用reRNA(transposon-derived right-end RNA,亦称ωRNA)作为向导的能力。进一步在人类细胞体系开展的基因组编辑实验显示,来自Clade 3、源于人类肠道细菌Lawsonibacter sp.的LaTranC系统,能够同时使用CRISPR RNA与ISDra2 TnpB的reRNA开展基因组编辑。这种兼具两种RNA识别能力的“双重导向”机制,是TranC系统作为TnpB向Cas12演化中间体的重要功能标志,也为理解CRISPR系统的起源提供了关键证据。
进一步的结构生物学分析揭示,TranC蛋白与其祖先TnpB蛋白在三维结构上高度保守,其差异主要体现在RNA层面。冷冻电镜解析表明,LaTranC与CRISPR RNA(tracrRNA + crRNA)形成的复合体,与其姊妹分支ISDra2 TnpB与reRNA形成的复合体在结构上高度一致。结构对比首次观测到,TnpB系统中由单一reRNA构成的向导RNA,在TranC中演化为功能分离的tracrRNA与crRNA两个模块,从而建立起典型的CRISPR双RNA导向结构。这一“RNA功能性分裂”的现象不仅在LaTranC中被验证,也通过AlphaFold结构预测和RNA共变异分析在其他TranC支系中被普遍观察,提示其为Cas12系统多次独立起源过程中的趋同进化特征。
为进一步验证RNA分裂在CRISPR系统起源中的关键作用,研究人员通过实验模拟了从TnpB到TranC的演化路径。结果表明,仅通过将ISDra2 TnpB的reRNA模块功能性拆分为嵌合型tracrRNA与LaTranC来源的crRNA两部分,即可赋予其利用CRISPR阵列进行靶向识别与基因组切割的能力。换言之,该系统已从单RNA导向的TnpB机制转变为双RNA导向的类CRISPR机制。综上,研究通过多学科方法,首次明确指出,RNA层面的功能性分裂与模块化创新,而非蛋白结构的根本性改变,是驱动CRISPR-Cas系统由转座子演变为免疫系统的核心分子机制。
中国科学院遗传与发育生物学研究所高彩霞研究员、生命中心研究员/清华大学生命科学学院刘俊杰副教授、中国科学院动物所张勇研究员为该论文的共同通讯作者。中国科学院遗传与发育生物学研究所已出站博士后(现清华大学生命学院博士后)靳帅、已毕业博士生朱子旭、博士生李运嘉和清华大学已出站博士后张寿悦为该论文共同第一作者。中国科学院遗传与发育生物学研究所已毕业博士生刘怡静、博士生程志恒、博士生杨广磊、助理研究员李洪超、助理研究员梁荣洪与副研究员张瑞,清华大学生命科学学院已毕业博士生李丹苑、中国科学院动物研究所李源清博士、中国科学院微生物研究所骆迎峰研究员、邱金龙研究员,齐禾生物科技有限公司首席技术官赵天萌博士、高强博士等在课题研究中做出了重要贡献。上海科技大学季泉江教授、中国科学院微生物研究所吴边研究员为本研究提供了重要实验材料。研究得到农业农村部项目、国家重点研发计划、国家自然科学基金、生命科学联合中心、中国科学院稳定支持基础研究领域青年团队项目和新基石科学基金项目的资助。
原文链接:
https://www.cell.com/cell/abstract/S0092-8674(25)01035-9
