
陈雷课题组揭示激活剂调控TRPC3通道的分子机制
经典瞬时受体电位通道(TRPC)是一类被受体信号调控的非选择性阳离子通道,可以介导阳离子的跨膜流动1。人体中共表达6种TRPC亚型(TRPC1、3、4、5、6、7)。根据序列同源性与激活机制的不同,可将其划分为两个亚家族:TRPC3/6/7可被第二信使DAG直接激活2,3;而TRPC1/4/5则不能直接响应DAG,其活性还受到PKC和NHERF等因子的调控4。TRPC3/6/7在多种组织中广泛表达,并参与重要的生理过程1。例如,TRPC3在中枢神经系统中高表达5,TRPC6在心、肺、胰腺和肾等器官中富集6,TRPC7则在肾脏和脑组织中显著表达6。该亚家族的功能异常与多种疾病相关,如TRPC6的功能获得性突变可导致家族性局灶节段性肾小球硬化(FSGS)7,8。
已有结构研究表明,TRPC3/6通道中存在三个钙离子结合位点及多个小分子化合物的结合口袋1。DAG是TRPC3/6/7的内源性激活剂1,先前研究提示TRPC3中存在两个脂质结合区域(L1和L2)10,且DAG可能结合于L2位点11,但其精确的结合机制仍有待阐明。
2025年10月22日,北大-清华生命科学联合中心,北京大学未来技术学院分子医学研究所陈雷研究员课题组在Nature Communications 上发表了题为“Structural mechanism of the agonist binding on human TRPC3 channel”的研究论文(链接见https://www.nature.com/articles/s41467-025-64435-6),描述了DAG结合人源TRPC3通道的结构基础。本研究通过单颗粒冷冻电镜技术,解析了多种激动剂条件下TRPC3的高分辨率三维结构。为提高结构稳定性和分辨率,研究团队与上海洛启生物合作,筛选并获得了一系列靶向TRPC3胞内结构域的高亲和力纳米抗体,使最终结构的整体分辨率提升至2.25 Å(图1)。
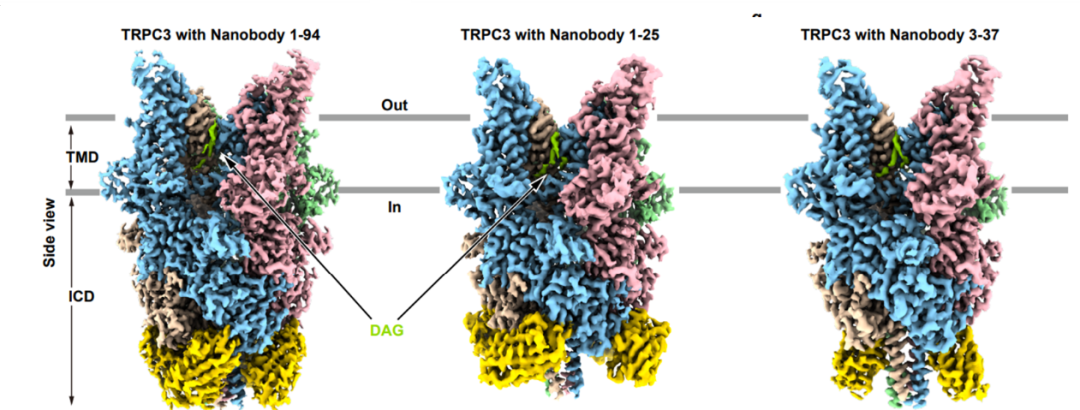
图1: 纳米抗体结合人源TRPC3复合体的冷冻电镜结构
结构分析联合质谱鉴定表明:DAG分子结合于TRPC3通道孔道外侧的L2位点,DAG分子甘油骨架末端的游离羟基(C3–OH)与TRPC3上的Glu603和Lys607形成关键氢键。该基团为DAG区别于其他甘油脂质的特征性结构。此外,DAG的疏水链与TRPC3跨膜区的多个疏水残基发生广泛互作。序列比对结果表明,这些关键氨基酸在TRPC3/6/7中高度保守(图2)。
图2: DAG在人源TRPC3中的结合位点
研究还解析了两种TRPC3/6高选择性小分子激动剂——4n与GSK1702934A——与TRPC3的复合物结构。结果显示,这两种化合物与DAG共享结合口袋,且关键相互作用残基高度重叠,说明该DAG结合位点对合成激动剂的激活同样至关重要(图3和图4)。
图4: GSK1702934A于人源TRPC3中的结合位点
由于DAG在细胞膜内内小叶合成,而其结合位点位于跨膜区近胞外侧,研究进一步通过电生理实验研究该位点的生物学功能。对DAG结合关键残基(E603A、K607A、V637A)进行点突变后,DAG介导的电流激活显著减弱甚至完全消失;突变体对4n和GSK的响应也大幅降低,但仍保留部分激活作用,证明这些突变体能表达在细胞膜表面上,并且具有通道功能。这一结果明确证实位于细胞膜外小叶的L2位点为DAG激活TRPC3/6/7通道的功能性结合位点(图5)。因为PLC催化细胞膜内小叶的PIP2水解生成DAG,而L2位点位于细胞膜外小叶,所以DAG在内小叶生成后会翻转至外小叶从而激活TRPC3/6/7通道。
图5: DAG和MAG结合于L2以激活TRPC3/6/7
基于DAG的结构特征,研究人员推测具有相同C3–OH基团的单酰甘油(MAG)也可能激活TRPC3/6/7。电生理实验表明,1-油酰基甘油(1-MOG)和2-油酰基甘油(2-MOG)均可有效激活TRPC3/6/7(图5),而对TRPC5无激活作用。这一发现不仅拓展了TRPC通道的内源性激活剂种类,也将TRPC3/6/7的功能与脂质代谢通路联系起来,为理解其在生理与病理状态下的调控机制提供了新视角。
综上所述,本研究通过高分辨率冷冻电镜结构解析与功能验证,首次阐明DAG结合TRPC3的分子机制,鉴定出其与合成激动剂的共享结合口袋,并发现MAG是一类新型内源性激活剂。该工作为TRPC3/6/7在心血管、肾脏及代谢相关疾病中的作用机制研究和靶向药物开发提供了重要理论依据(图6)。
图6: GPCR和MAG介导的TRPC3/6/7通道激活的示意图。
北京大学前沿交叉学科研究院生物医学跨学科研究中心博士研究生陈逸坤、未来技术学院博士研究生臧佳和、博士后郭文君为本文共同第一作者。北大-清华生命科学联合中心PI陈雷研究员为通讯作者。该工作还得到陈雷课题组博士生徐家璇、韦淼的协助。未来技术学院代谢平台的权力老师进行了质谱检测实验;纳米抗体由上海洛启生物医药技术有限公司的朱敏博士与万亚坤博士制作;石墨烯载网由北京大学化学与分子工程学院赵效乐博士与彭海琳教授制作。本研究获科技部重点研发、国家自然科学基金、北大-清华生命科学联合中心等经费支持,冷冻电镜数据在北京大学冷冻电镜平台完成采集,得到了工作人员李雪梅、郭振玺、秦昌东和王国鹏等人的支持。该项目的部分数据处理获得了北京大学CLS计算平台及未名超算平台的硬件和技术支持。
参考文献
1.Wang, H. et al. TRPC channels: Structure, function, regulation and recent advances in small molecular probes. Pharmacol. Ther. 209, 107497 (2020). https://doi.org:10.1016/j.pharmthera.2020.107497
2.Hofmann, T. et al. Direct activation of human TRPC6 and TRPC3 channels by diacylglycerol. Nature 397, 259-263 (1999). https://doi.org:10.1038/16711
3.Beck, B. et al. TRPC7 is a receptor-operated DAG-activated channel in human keratinocytes. J. Invest. Dermatol. 126, 1982-1993 (2006). https://doi.org:10.1038/sj.jid.5700352
4.Storch, U. et al. Dynamic NHERF interaction with TRPC4/5 proteins is required for channel gating by diacylglycerol. Proc. Natl. Acad. Sci. U. S. A. 114, E37-E46 (2017). https://doi.org:10.1073/pnas.1612263114
5.Zhu, X. et al. trp, a novel mammalian gene family essential for agonist-activated capacitative Ca2+ entry. Cell 85, 661-671 (1996).
6.Riccio, A. et al. mRNA distribution analysis of human TRPC family in CNS and peripheral tissues. Brain Res. Mol. Brain Res. 109, 95-104 (2002). https://doi.org:10.1016/s0169-328x(02)00527-2
7.Reiser, J. et al. TRPC6 is a glomerular slit diaphragm-associated channel required for normal renal function. Nat. Genet. 37, 739-744 (2005). https://doi.org:10.1038/ng1592
8.Winn, M. P. et al. A mutation in the TRPC6 cation channel causes familial focal segmental glomerulosclerosis. Science 308, 1801-1804 (2005). https://doi.org:10.1126/science.1106215
9.Guo, W. et al. Structural mechanism of human TRPC3 and TRPC6 channel regulation by their intracellular calcium-binding sites. Neuron (2022). https://doi.org:10.1016/j.neuron.2021.12.023
10.Fan, C., Choi, W., Sun, W., Du, J. & Lu, W. Structure of the human lipid-gated cation channel TRPC3. Elife 7 (2018). https://doi.org:10.7554/eLife.36852
11.Erkan-Candag, H. et al. Diacylglycerols interact with the L2 lipidation site in TRPC3 to induce a sensitized channel state. EMBO Rep. 23, e54276 (2022). https://doi.org:10.15252/embr.202154276
