饶毅实验室开发一种用于精氨酸的基因编码探针
L-精氨酸(Arg)在多种代谢和生理过程中发挥着重要作用,其浓度的变化与病理过程密切相关。2025年1月21日,饶毅课题组在
ACS Sensors期刊发表题为“Development of a Genetically Encoded Sensor for Arginine”的最新研究成果。本研究开发了一种新的Arg探针——ArgS1,可有效在生理和病理相关动态范围内实时监测人类细胞中的Arg水平。

L-精氨酸(Arg)在多种代谢和生理过程中发挥重要作用,其浓度的变化与病理过程密切相关。尽管直接且实时测量生物系统中的Arg水平非常重要,但现有的Arg探针对L-鸟氨酸或L-赖氨酸也有响应。本文报道了一种新的Arg探针ArgS1。该探针对Arg表现出浓度依赖性的Ex488/405比率增加,其表观亲和力约为64μM,动态范围(ΔR/R0)为3。ArgS1在细胞质和亚细胞器中对Arg均有响应。ArgS1成功监测了MDA-MB-231细胞(一种缺乏Arg合成关键酶——精氨琥珀酸合成酶1(ASS1)的乳腺癌细胞系,且适用于Arg耗竭疗法)中的Arg水平。研究发现,当细胞外Arg被耗竭后,MDA-MB-231细胞中的Arg水平下降,同时细胞活力也随之降低。当细胞中过表达ASS1时,Arg水平上升,细胞活力也得到增强。因此,ArgS1是一种在生理和病理相关动态范围内实时监测人类细胞中Arg水平的有效工具。
L-精氨酸(Arg)是一种条件性必需氨基酸,在人体中具有重要的生理作用[1, 2]。Arg的主要来源包括蛋白质降解、膳食摄入和从头合成[3]。Arg的合成涉及两种关键酶:精氨琥珀酸合成酶(ASS),它将L-瓜氨酸(Cit)转化为精氨琥珀酸;以及精氨琥珀酸裂解酶(ASL),它将精氨琥珀酸裂解为Arg[4, 5]。Arg在一氧化氮合酶(NOS)的催化下生成Cit和一氧化氮(NO),Arg是NO的唯一直接前体[6-9]。Arg还参与尿素循环,在精氨酸酶(ARGs)的作用下被水解为尿素和L-鸟氨酸(Orn)[10, 11],这对于氨的解毒至关重要[12]。精氨酸:甘氨酸脒基转移酶(AGAT)是一种线粒体酶,它催化Arg生成胍基乙酸,这是肌酸合成的直接前体[13-15]。Arg代谢紊乱与多种疾病相关[5, 16]。精氨酸酶1(ARG1)缺乏会导致高精氨酸血症,这是一种以进行性神经系统症状为特征的罕见遗传性代谢疾病[17]。Arg还与多种疾病的治疗相关,例如勃起功能障碍[18, 19]、高血压[20]和心力衰竭[21]。
癌细胞的生存和生长需要氨基酸[22-24],其中Arg是肿瘤微环境中的重要组成部分[25-27]。某些类型的癌症,如乳腺癌[28]、黑色素瘤[29]、肝细胞癌[30]、急性淋巴细胞白血病(ALL)[31]和急性髓系白血病(AML)[32],其ASS表达缺失。这些类型的癌细胞依赖摄取细胞外Arg以维持生存,因此限制Arg供应已被探索为癌症治疗中的一种潜在辅助治疗策略[27, 33]。在培养基中去除Arg或添加ADI-PEG20(聚乙二醇化精氨酸脱亚氨酶)可导致ASS1缺陷型癌细胞在体外被清除[28, 34]。系统性给予ADI或精氨酸酶以限制Arg可用性,已在肿瘤治疗的II期临床试验中进行了研究[35]。这些研究表明,ASS1缺陷是AML患者对ADI-PEG20单药治疗产生反应的必要条件,但并非充分条件。Arg的测量是确定患者是否适合接受ADI-PEG20治疗AML的重要指标。
传统的Arg测量方法包括样品的微透析[36, 37]和化学分析[38],这些方法无法研究细胞内分布的变化,也无法以必要的空间和时间分辨率分析Arg。荧光探针提供了非侵入性实时测量浓度及其时空变化的可能性。现有的基因编码Arg荧光探针基于Förster共振能量转移(FRET),其动态范围相对较小[39-41]。这些探针在体外报道的最大动态范围仅为约0.6[40]。更大的问题在于其特异性:这些探针不仅对Arg有响应,还对其他氨基酸(如Orn、L-赖氨酸(Lys)、L-谷氨酰胺(Gln)和L-组氨酸(His))有响应[39-41]。此外,这些探针对Arg的解离常数(Kd)(9.4或14μM)[39, 40]不适合检测生理水平的Arg,因为血浆[42]和细胞质[43]中的Arg浓度通常约为100µM。
因此,需要开发具有大动态范围和合适Kd的基因编码Arg特异性荧光探针,以用于生理和病理条件下Arg的检测。
Arg探针的设计、优化及体外表征
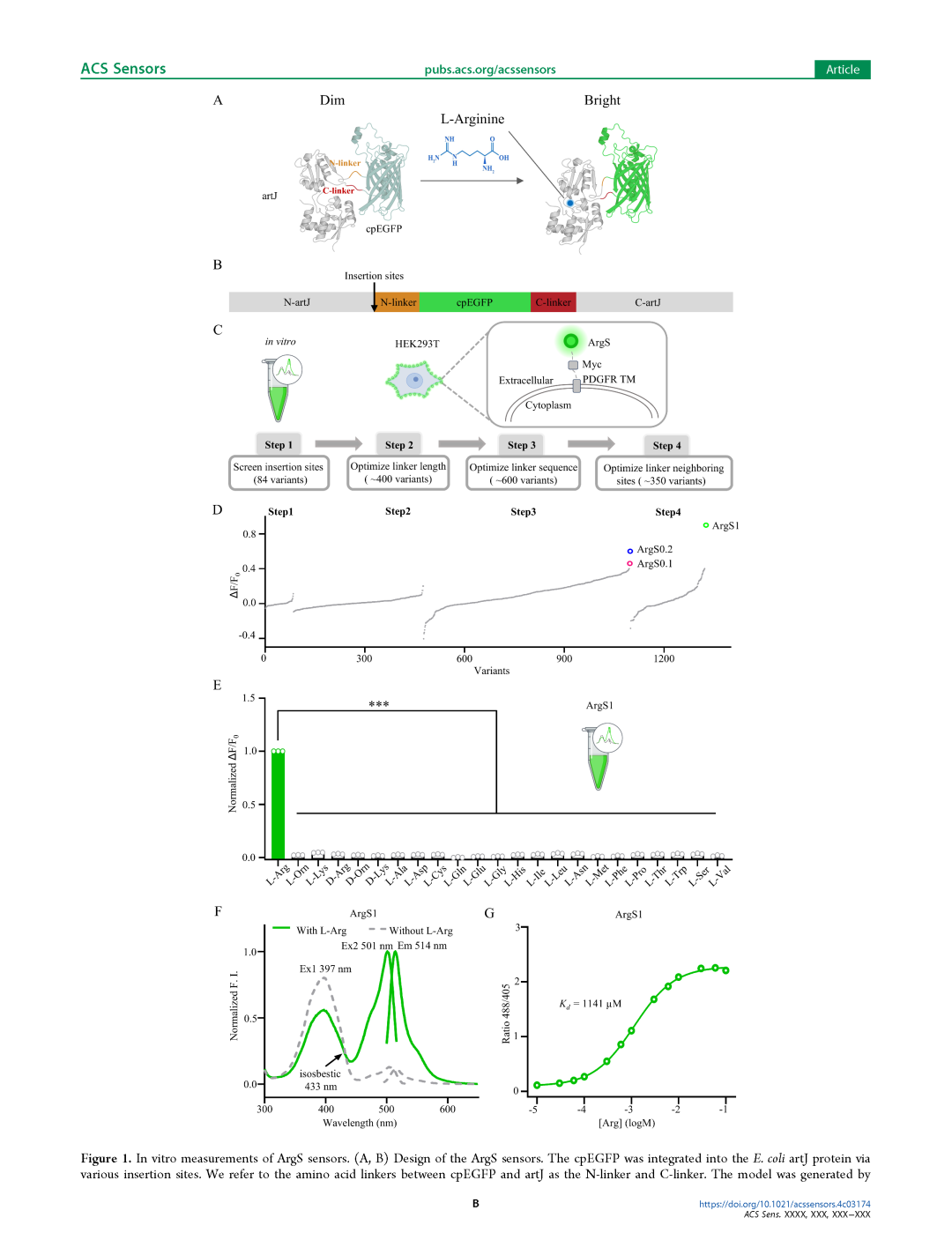
我们基于大肠杆菌(E. coli)的artJ(一种周质结合蛋白,PBP)设计了一种基因编码的荧光Arg探针。artJ在结合Arg时会发生构象变化[44-46]。与其他探针的设计类似[47-50],我们将来自GRABDA2m的环状置换绿色荧光蛋白(cpEGFP)[51]整合到artJ中(图1A、B)。根据artJ和argT(一种Arg、Lys和Orn结合蛋白)的晶体结构,其叶II的环区和铰链区在底物结合时会发生显著构象变化[45, 46, 52-56],这为cpEGFP的插入提供了潜在的位点。首先,我们在纯化蛋白上筛选了cpEGFP的插入位点(图1C)。artJ与cpEGFP之间的连接肽设计为柔性(Gly-Gly)或刚性(Pro-Pro)。基于初步筛选结果,我们选择了动态范围大于0.1的探针(图1D)。考虑到基于蛋白纯化的筛选方法耗时较长,且在体外响应的探针在细胞环境中可能表现不同,我们转而使用HEK293T细胞进行筛选。通过将探针与iSeroSnFR的膜靶向序列融合[57],我们将探针靶向到人胚胎肾293T(HEK293T)细胞的细胞膜上,以优化连接肽的长度和氨基酸组成,从而最小化细胞内Arg对探针响应的影响。我们发现,在HEK293T细胞膜上表现出良好响应的探针的响应值分别为0.4和0.6,分别命名为ArgS0.1和ArgS0.2(图1C、D,图S1C)。随后,我们优化了连接肽邻近位点,发现响应最佳的探针的响应值为0.9,命名为ArgS1(图1D,图S1C)。总结而言,通过对1200多种不同变体的筛选,我们最终确定了三种探针,分别命名为ArgS0.1、ArgS0.2和ArgS1(图1D)。
我们将这三种探针分别在大肠杆菌中表达并纯化,随后测试了它们对各种氨基酸的特异性。结果显示,所有三种ArgS探针均特异性地响应L-Arg,而对其他氨基酸的L型或D型均无响应(图1E,图S2A、B)。这三种ArgS探针均表现出比率特性,具有两个激发峰(分别位于400纳米(nm)和500 nm附近)和一个发射峰(位于515 nm附近)。当与1 mM Arg结合时,三种探针的400nm激发峰降低,而500nm激发峰增加(图1F,图S2C、D)。我们还测量了ArgS0.1、ArgS0.2和ArgS1的Arg结合亲和力,其Kd值分别为73μM、367μM和1141μM,荧光峰值变化(ΔR/R0)分别为1.9、4.6和19(图1G,图S2E、F)。同时,我们评估了ArgS探针对精氨酸相关代谢物的特异性。ArgS0.1对胍丁胺、Cit和精氨琥珀酸表现出可检测的响应,而ArgS0.2和ArgS1仅对Cit和精氨琥珀酸有响应(图S3A、D、G)。在瓜氨酸(Cit)结合实验中,ArgS0.1、ArgS0.2和ArgS1的Kd分别为312 μM、1162 μM和2912 μM,其荧光峰值变化约为Arg的一半(图S3B、E、H)。对于精氨琥珀酸的结合,所有探针的Kd值均超过300 μM(图S3C、F、G)。为了减少Arg相关代谢物的潜在干扰,我们通过LC-MS定量分析了HEK293T和MDA-MB-231细胞中这些代谢物的细胞内浓度。在两种细胞系中,Cit和精氨琥珀酸的浓度均低于5 μM(HEK293T细胞中Cit为1.290 μM,MDA-MB-231细胞中Cit为3.920 μM;HEK293T细胞中精氨琥珀酸为1.556 μM,MDA-MB-231细胞中精氨琥珀酸为4.156 μM),均低于ArgS探针的检测阈值(图S3J)。因此,在检测HEK293T或MDA-MB-231细胞中的Arg水平时,Cit或精氨琥珀酸的潜在干扰可忽略不计。此外,基于嗜热脂肪土芽孢杆菌(Geobacillus stearothermophilus)artJ的晶体结构[45],我们开发了三种ArgS1探针的突变版本。其中,双点突变版本ArgS1-F51L E114L对Arg几乎无响应(图S4C)。因此,该版本探针ArgS1-F51L E114L被命名为ArgS1-C,并作为后续实验的对照。为了研究pH依赖性,我们在pH 4至9的范围内测试了ArgS1和ArgS1-C。ArgS1在pH 7至8之间对Arg的响应最佳(图S4A),而ArgS1和ArgS1-C的apo形式在整个测试范围内表现出相似的pH依赖性行为(图S4B)。
Arg探针在HEK293T细胞质及亚细胞器中检测Arg变化
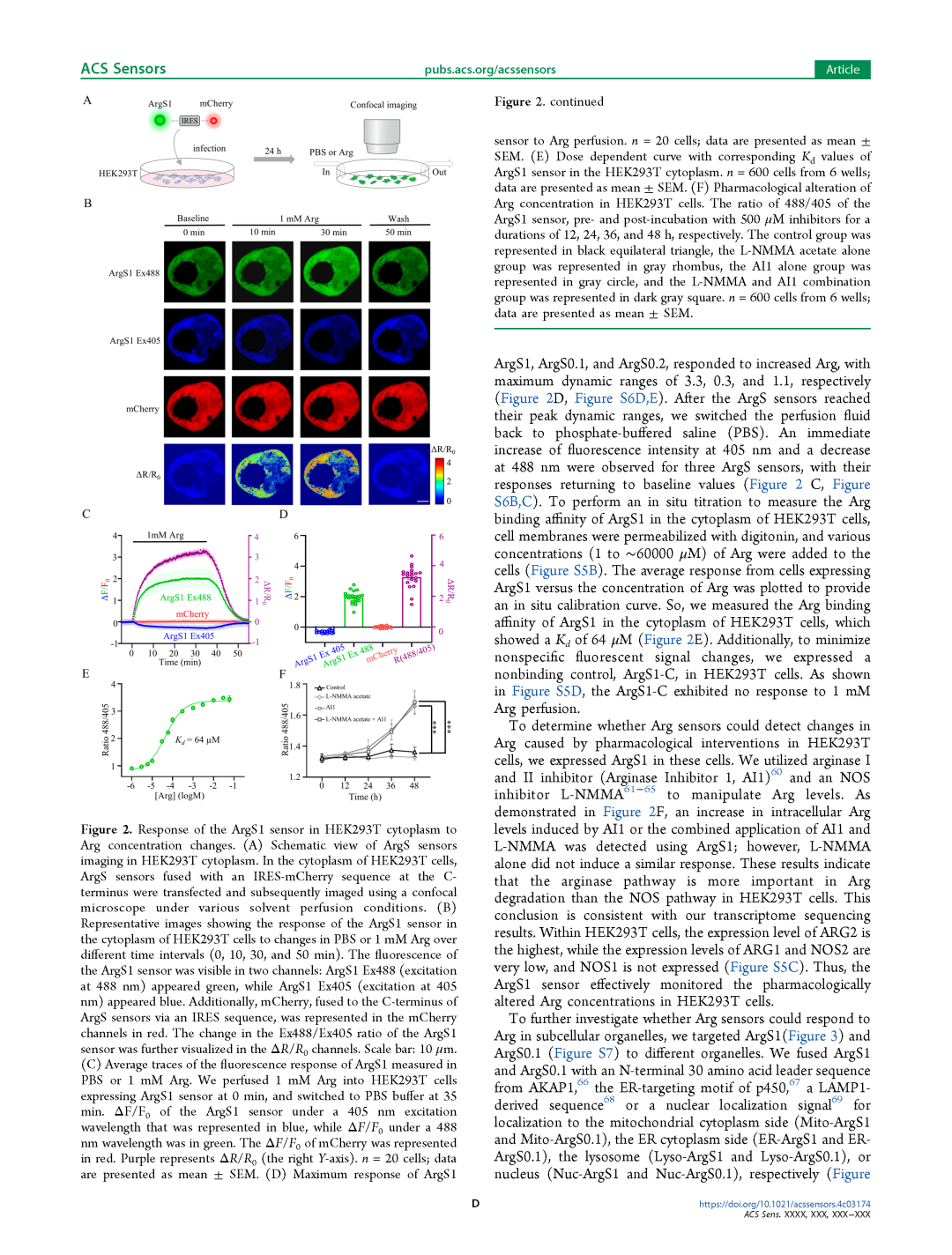
为了研究Arg探针是否能够在哺乳动物细胞中检测Arg,我们在HEK293T细胞的细胞质中表达了ArgS0.1、ArgS0.2和ArgS1(图2A)。Arg转运蛋白SLC7A1[58]和SLC7A2[59]在HEK293T细胞中高表达(图S5A)。当细胞外Arg浓度升高至1 mM时,我们立即观察到ArgS1、ArgS0.1和ArgS0.2在405 nm处的荧光强度下降,而在488 nm处的荧光强度增加(图2B,图S6A)。这表明所有三种探针(ArgS1、ArgS0.1和ArgS0.2)均对Arg的增加作出了响应,其最大动态范围分别为3.3、0.3和1.1(图2D,图S6D、E)。当Arg探针达到其峰值动态范围后,我们将灌注液切换回磷酸盐缓冲液(PBS),观察到三种探针在405 nm处的荧光强度立即增加,而在488 nm处的荧光强度下降,其响应恢复到基线值(图2C,图S6B、C)。
为了在HEK293T细胞质中进行原位滴定以测量ArgS1的Arg结合亲和力,我们用毛地黄皂苷(digitonin)透化细胞膜,并向细胞中添加不同浓度(1至∼60000 μM)的Arg(图S5B)。通过绘制表达ArgS1的细胞平均响应与Arg浓度的关系,获得了原位校准曲线。因此,我们测量了ArgS1在HEK293T细胞质中的Arg结合亲和力,其Kd值为64 μM(图2E)。此外,为了最小化非特异性荧光信号变化,我们在HEK293T细胞中表达了非结合对照探针ArgS1-C。如图S5D所示,ArgS1-C对1 mM Arg灌注无响应。
为了确定Arg探针是否能够检测由药物干预引起的HEK293T细胞中Arg的变化,我们在这些细胞中表达了ArgS1。我们利用精氨酸酶I和II抑制剂(Arginase Inhibitor 1, AI1)[60]和一氧化氮合酶(NOS)抑制剂L-NMMA[61-65]来调控Arg水平。如图2F所示,使用ArgS1检测到AI1或AI1与L-NMMA联合应用引起的细胞内Arg水平升高;然而,单独使用L-NMMA并未诱导类似的响应。这些结果表明,在HEK293T细胞中,精氨酸酶途径在Arg降解中的作用比NOS途径更为重要。这一结论与我们的转录组测序结果一致。在HEK293T细胞内,ARG2的表达水平最高,而ARG1和NOS2的表达水平非常低,NOS1则未表达(图S5C)。因此,ArgS1探针有效地监测了HEK293T细胞中药理干预引起的Arg浓度变化。
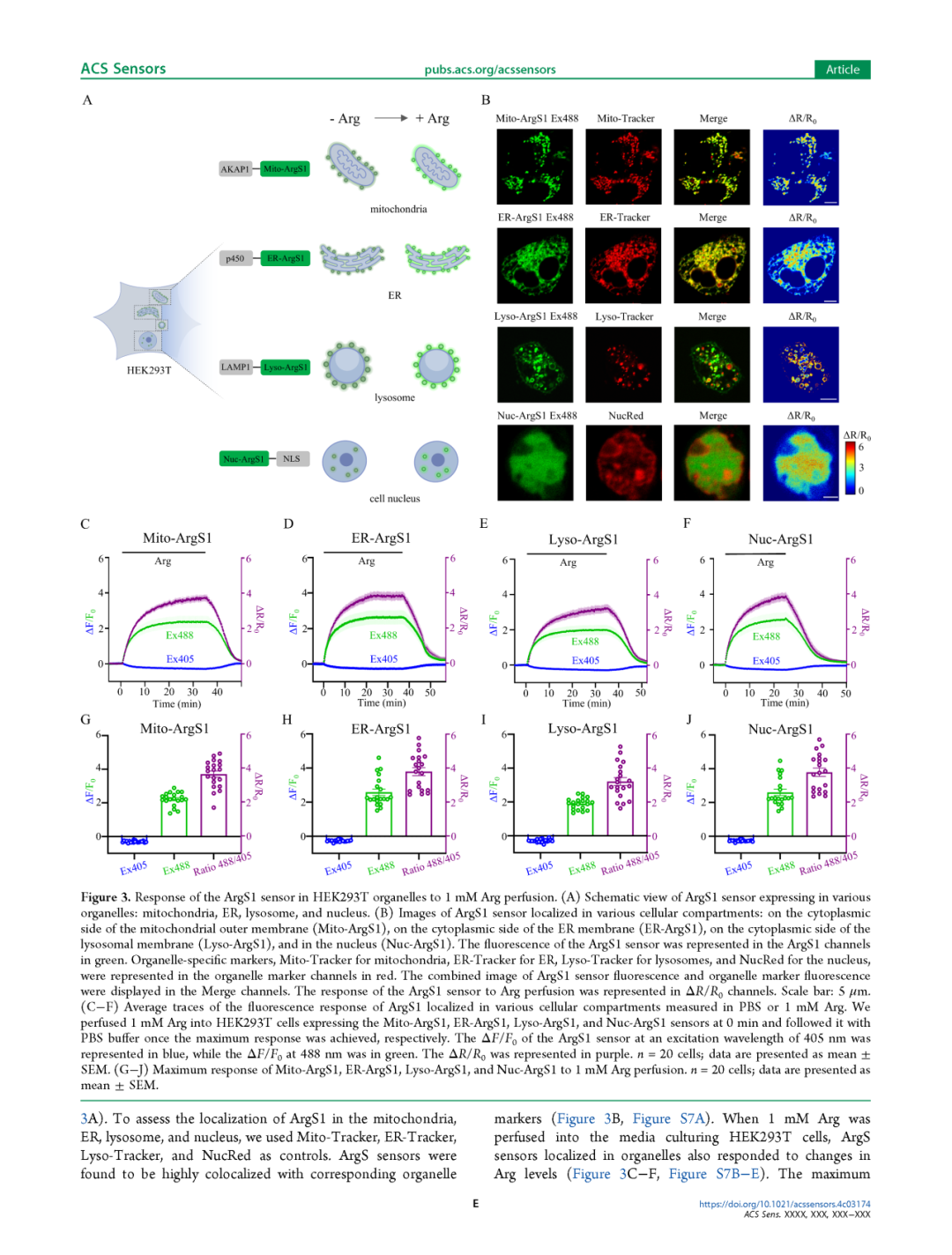
为了进一步研究Arg探针是否能够响应亚细胞器中的Arg,我们将ArgS1(图3)和ArgS0.1(图S7)靶向到不同的细胞器。我们将ArgS1和ArgS0.1分别与AKAP1的N端30个氨基酸引导序列[66]、p450的内质网(ER)靶向基序[67]、LAMP1衍生的序列[68]或核定位信号[69]融合,以定位到线粒体胞质侧(Mito-ArgS1和Mito-ArgS0.1)、ER胞质侧(ER-ArgS1和ER-ArgS0.1)、溶酶体(Lyso-ArgS1和Lyso-ArgS0.1)或细胞核(Nuc-ArgS1和Nuc-ArgS0.1)(图3A)。为了评估ArgS1在线粒体、ER、溶酶体和细胞核中的定位,我们分别使用Mito-Tracker、ER-Tracker、Lyso-Tracker和NucRed作为对照。结果显示,ArgS探针与相应的细胞器标记物高度共定位(图3B,图S7A)。当向培养HEK293T细胞的培养基中灌注1 mM Arg时,定位在细胞器中的ArgS探针也对Arg水平的变化作出了响应(图3C-F,图S7B-E)。Mito-ArgS1、ER-ArgS1、Lyso-ArgS1和Nuc-ArgS1探针的最大动态范围分别为3.7、3.8、3.2和3.8(图3G-J),而Mito-ArgS0.1、ER-ArgS0.1、Lyso-ArgS0.1和Nuc-ArgS0.1探针的最大动态范围分别为0.5、0.5、0.4和0.6(图S7F-I)。这些结果表明,ArgS探针在线粒体、ER和溶酶体附近区域以及细胞核内的响应相似。因此,我们成功开发了能够监测哺乳动物细胞质和亚细胞器中Arg的ArgS探针。
细胞外Arg剥夺导致癌细胞细胞内Arg水平下降
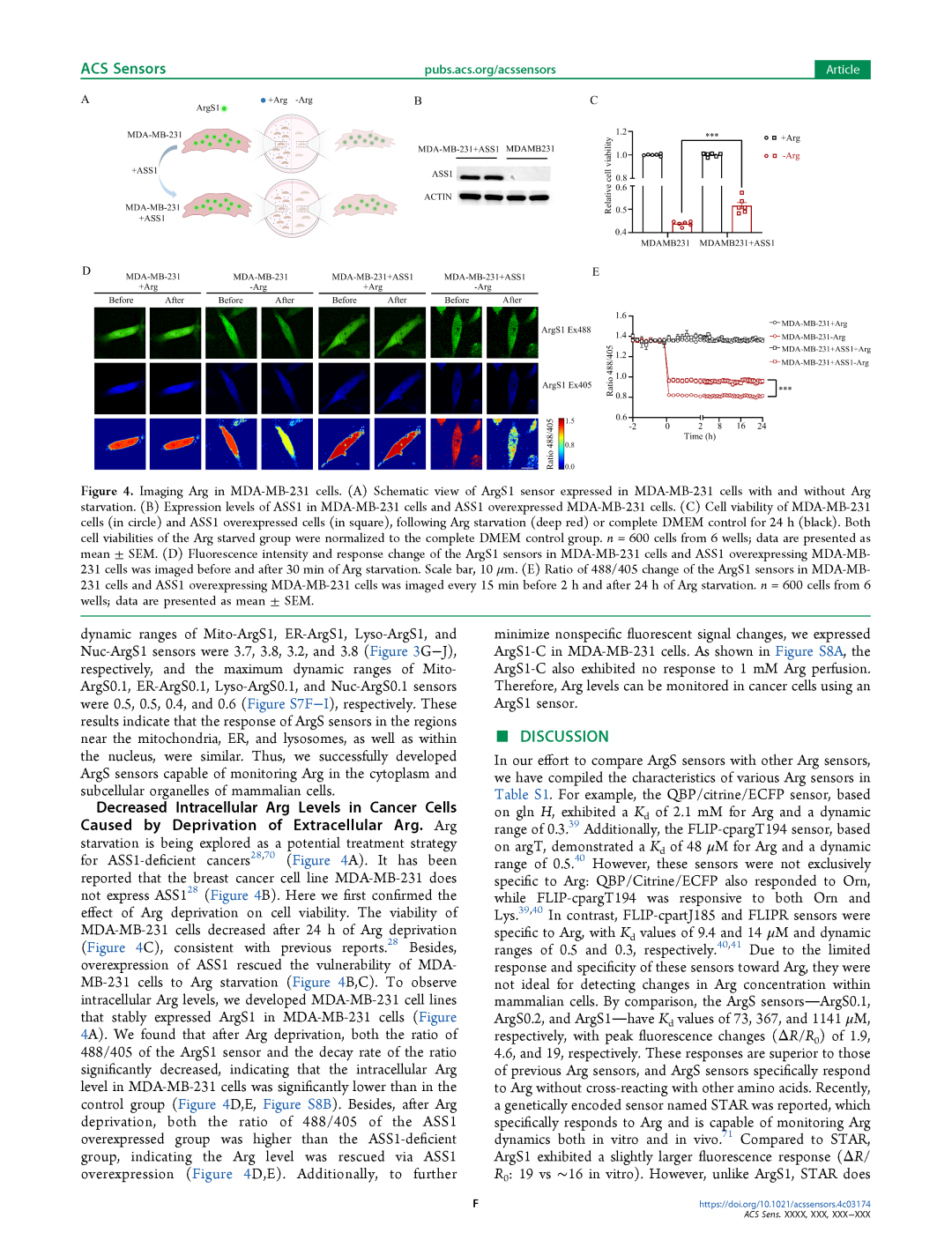
Arg饥饿正被探索为一种针对ASS1缺陷型癌症的潜在治疗策略[28, 70](图4A)。据报道,乳腺癌细胞系MDA-MB-231不表达ASS1[28](图4B)。我们首先验证了Arg剥夺对细胞活力的影响。Arg剥夺24小时后,MDA-MB-231细胞的活力下降(图4C),这与之前的报道一致[28]。此外,过表达ASS1能够回补MDA-MB-231细胞对Arg饥饿的敏感性(图4B、C)。为了观察细胞内Arg水平,我们开发了在MDA-MB-231细胞中稳定表达ArgS1的细胞系(图4A)。我们发现,Arg剥夺后,ArgS1探针的488/405比率及其衰减速率均显著下降,表明MDA-MB-231细胞内的Arg水平显著低于对照组(图4D、E,图S8B)。此外,Arg剥夺后,ASS1过表达组的488/405比率高于ASS1缺陷组,表明通过ASS1过表达回补了Arg水平(图4D、E)。此外,为了进一步减少非特异性荧光信号变化,我们在MDA-MB-231细胞中表达了ArgS1-C。如图S8A所示,ArgS1-C对1 mM Arg灌注也无响应。因此,ArgS1探针可用于监测癌细胞中的Arg水平。
为了将ArgS探针与其他Arg探针进行比较,我们整理了各种Arg探针的特性,如表S1所示。例如,基于glnH的QBP/Citrine/ECFP探针对Arg的Kd为2.1 mM,动态范围为0.3[39]。此外,基于argT的FLIP-cpargT194探针对Arg的Kd为48 μM,动态范围为0.5[40]。然而,这些探针并非对Arg完全特异:QBP/Citrine/ECFP还对Orn有响应,而FLIP-cpargT194对Orn和Lys均有响应[39, 40]。相比之下,FLIP-cpartJ185和FLIPR探针对Arg具有特异性,其Kd值分别为9.4 μM和14 μM,动态范围分别为0.5和0.3[40, 41]。由于这些探针对Arg的响应和特异性有限,它们并不适合检测哺乳动物细胞内Arg浓度的变化。相比之下,ArgS探针——ArgS0.1、ArgS0.2和ArgS1的Kd值分别为73 μM、367 μM和1141 μM,荧光峰值变化(ΔR/R0)分别为1.9、4.6和19。这些响应优于以往的Arg探针,且ArgS探针特异性地响应Arg,而不会与其他氨基酸发生交叉反应。最近,研究人员报道了一种名为STAR的基因编码探针,它特异性地响应Arg,并能够在体外和体内监测Arg动态[71]。与STAR相比,ArgS1的荧光响应略大(ΔR/R0:19 vs. ~16,体外)。然而,与ArgS1不同,STAR不具备比率特性,因此需要额外的对照来校正探针表达水平的变化。
为了增强ArgS探针的最大响应,我们筛选了不同长度和组成的连接肽。结果表明,N端连接肽为2或3个氨基酸、C端连接肽为2个氨基酸时,响应更大,且N端连接肽的首个氨基酸优选为Gly。此外,在筛选过程的第4步中,测试了N端连接肽邻近的氨基酸残基。例如,将该残基替换为Ile显著提高了响应,从而开发出了ArgS1。尽管我们筛选了1200多个候选变体,但通过进一步扩展筛选范围以包括更多邻近连接肽位点,仍有可能实现进一步改进。
具体而言,HEK293T细胞质中的ArgS1的Kd值为64 μM,高于体外测量的值。类似地,iGluSnFR探针在HEK293T细胞或培养的海马神经元中的亲和力也高于体外观察到的值[47, 49, 72]。这种差异可能是由于蛋白质在不同环境和检测系统中的暴露差异,也可能是细胞环境中的辅助因子增强了Arg结合的结果。然而,即使在体外实验中加入细胞裂解液后,测得的Kd仍处于毫摩尔范围,这表明需要进一步研究。因此,为了准确量化不同环境中的Arg水平,应在多种实验条件下测量Kd以考虑这些因素。此外,ArgS1对Cit和精氨琥珀酸表现出可检测的响应。在测量不同生物环境中的Arg水平时,必须确保Cit和精氨琥珀酸的浓度低于ArgS1探针的检测阈值。
关于ArgS探针在不同亚细胞位置的动态特性,Nuc-ArgS1和ER-ArgS1的Arg灌注时间比其他位置短,这可能反映了亚细胞间Arg代谢的差异(图3C-F)。此外,我们尝试确定每个亚细胞位置的基线Arg浓度;然而,我们不确定灌注前的初始比率是否准确反映了基线浓度,因为探针游离形式的荧光比率可能在不同亚细胞区室中有所不同。此外,在每个亚细胞位置除去Arg以获得ArgS探针的游离形式具有挑战性。因此,我们选择在获得更可靠的方法来获取这些区室中ArgS探针的游离形式之前,不对亚细胞位置的Arg浓度进行量化。
Arg在生理和病理过程中发挥着关键作用;然而,其许多功能仍未得到充分理解。例如,星形胶质细胞和神经元之间Arg转运的机制尚不清楚,其作为信号分子的作用也未明确定义。此外,Arg浓度的变化可以与其他分子(如Ca²⁺、cAMP和Glu)一起使用互补的荧光探针进行监测。我们希望ArgS探针能够有助于阐明Arg代谢的机制,并为其生理和病理作用提供更深入的见解。
总之,ArgS1能够实时检测多种哺乳动物细胞中Arg水平的变化,为基础研究和临床应用提供了宝贵的工具。这是首个能够动态监测哺乳动物细胞内Arg浓度变化的基因编码荧光探针。此外,ArgS1在亚细胞器中对Arg表现出动态响应,并已成功用于监测MDA-MB-231乳腺癌细胞中的Arg水平。
我们感谢李毓龙教授提供GRABDA2m质粒。我们感谢国家蛋白质科学基础设施——北京基地北京大学分设施在Operetta高内涵成像实验提供的帮助。我们感谢北京脑科学与类脑研究所生物质谱中心于晓倩老师在LC-MS实验提供的帮助。
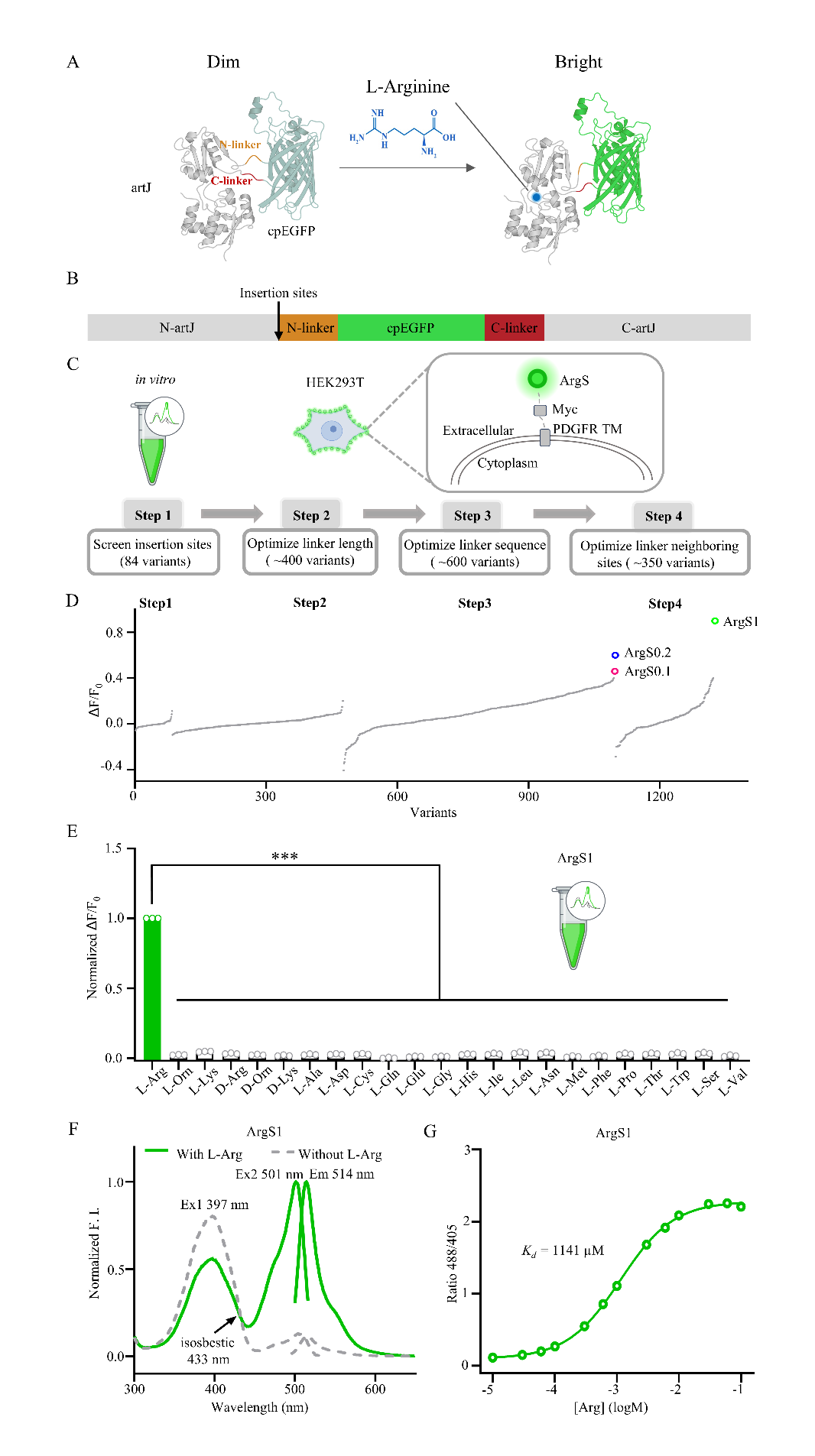
图1 ArgS探针的体外测量
A, B ArgS探针的设计。通过不同的插入位点将cpEGFP整合到大肠杆菌artJ蛋白中。我们将cpEGFP与artJ之间的氨基酸连接肽称为N端连接肽和C端连接肽。该模型使用AlphaFold2生成。
C ArgS探针的筛选流程。第1步是在纯化蛋白上进行插入位点筛选,第2至第4步是在HEK293T细胞膜上进行筛选,其中第2步和第3步分别优化连接肽的长度和组成,第4步优化连接肽邻近位点。
D ArgS探针的筛选结果。ArgS0.1、ArgS0.2和ArgS1探针分别用洋红色、蓝色和绿色突出显示。
E ArgS1探针的氨基酸特异性。对1 mM各种氨基酸的响应归一化为对1 mM L-Arg的响应。每组数据点n = 3;数据以均值±标准误(SEM)表示。
F ArgS1探针在有无1 mM Arg条件下的激发和发射光谱。
G ArgS1探针在不同浓度Arg暴露下的剂量响应曲线。每组数据点n = 6;数据以均值±标准误(SEM)表示。
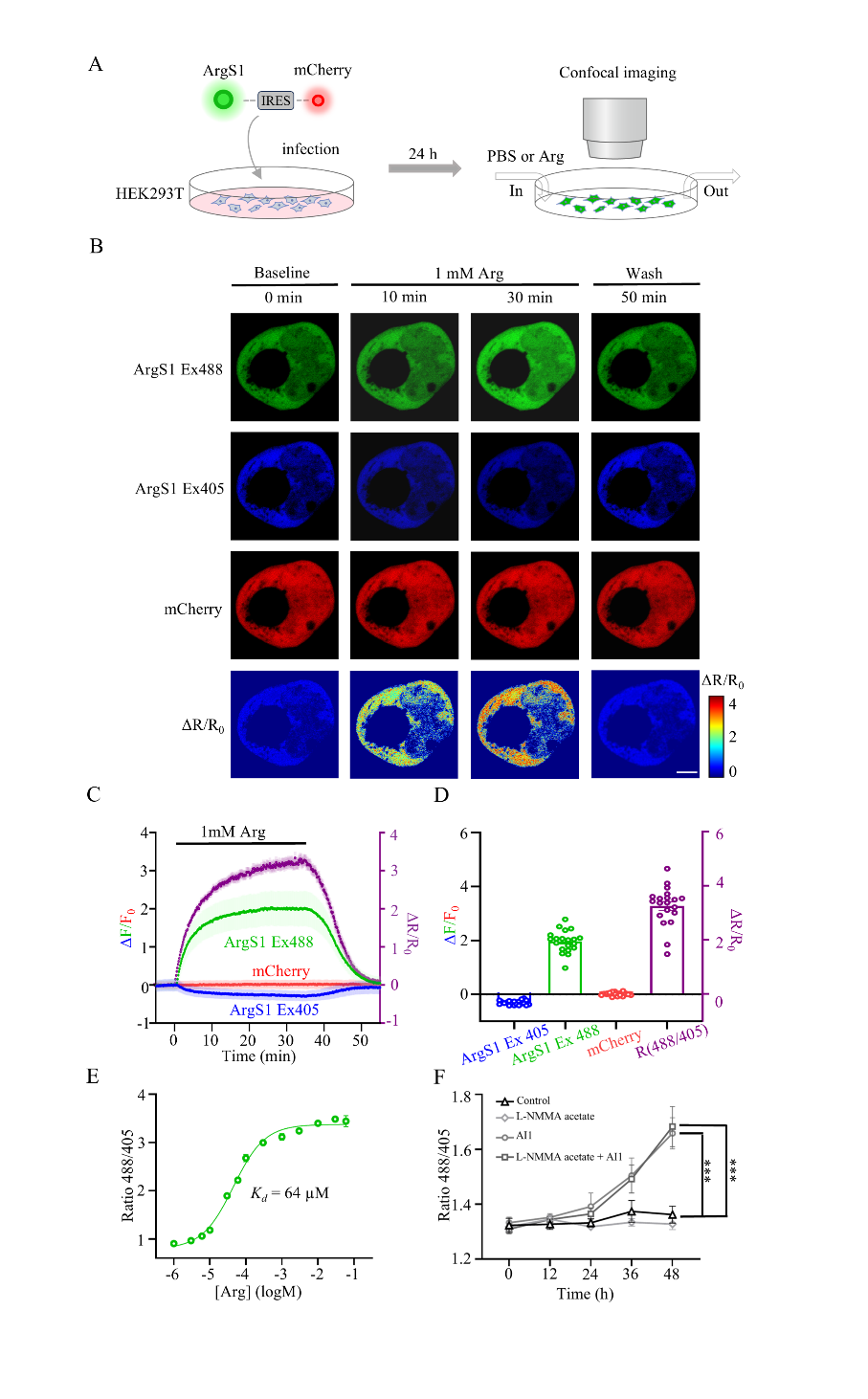
图2 ArgS1探针在HEK293T细胞质中对Arg浓度变化的响应
A ArgS探针在HEK293T细胞质中成像的示意图。在HEK293T细胞的细胞质中,C端融合IRES-mCherry序列的ArgS探针被转染,随后在不同溶剂灌注条件下使用共聚焦显微镜进行成像。
B 代表性图像显示ArgS1探针在HEK293T细胞质中对PBS或1 mM Arg变化在不同时间点(0分钟、10分钟、30分钟和50分钟)的响应。ArgS1探针的荧光在两个通道中可见:ArgS1 Ex488(激发波长488 nm)显示为绿色,而ArgS1 Ex405(激发波长405 nm)显示为蓝色。此外,通过IRES序列融合到ArgS探针C端的mCherry在mCherry通道中以红色显示。ArgS1探针的Ex488/Ex405比率变化进一步在ΔR/R0通道中可视化。比例尺:10 μm。
C ArgS1在PBS或1 mM Arg中荧光响应的平均轨迹。我们在0分钟时将1 mM Arg灌注到表达ArgS1探针的HEK293T细胞中,并在35分钟时切换为PBS缓冲液。ArgS1探针在405 nm激发波长下的ΔF/F0以蓝色表示,而在488 nm波长下的ΔF/F0以绿色表示。mCherry的ΔF/F0以红色表示。紫色表示ΔR/R0(右侧Y轴)。每组n = 20个细胞;数据以均值±标准误(SEM)表示。
D ArgS1探针对Arg灌注的最大响应。每组n = 20个细胞;数据以均值±标准误(SEM)表示。
E ArgS1探针在HEK293T细胞质中的剂量依赖曲线及相应的Kd值。每组n = 600个细胞(来自6个孔);数据以均值±标准误(SEM)表示。
F HEK293T细胞中Arg浓度的药理学改变。ArgS1探针的488/405比率在分别与500 μM抑制剂孵育12、24、36和48小时前后的变化。对照组以黑色等边三角形表示,单独L-NMMA组以灰色菱形表示,单独AI1组以灰色圆形表示,L-NMMA和AI1联合组以深灰色方形表示。每组n = 600个细胞(来自6个孔);数据以均值±标准误(SEM)表示。
图3 ArgS1探针在HEK293T细胞器中对1 mM Arg灌注的响应
A ArgS1探针在不同细胞器中表达的示意图:线粒体、内质网(ER)、溶酶体和细胞核。
B ArgS1探针定位在不同细胞区室的图像:线粒体外膜的胞质侧(Mito-ArgS1)、ER膜的胞质侧(ER-ArgS1)、溶酶体膜的胞质侧(Lyso-ArgS1)以及细胞核内(Nuc-ArgS1)。ArgS1探针的荧光在ArgS1通道中以绿色表示。细胞器特异性标记物,包括线粒体的Mito-Tracker、ER的ER-Tracker、溶酶体的Lyso-Tracker和细胞核的NucRed,在细胞器标记通道中以红色表示。ArgS1探针荧光与细胞器标记荧光的合并图像显示在Merge通道中。ArgS1探针对Arg灌注的响应在ΔR/R0通道中表示。比例尺:5 μm。
C-F 定位在不同细胞区室的ArgS1在PBS或1 mM Arg中荧光响应的平均轨迹。我们在0分钟时将1 mM Arg灌注到表达Mito-ArgS1、ER-ArgS1、Lyso-ArgS1和Nuc-ArgS1探针的HEK293T细胞中,并在达到最大响应后分别切换为PBS缓冲液。ArgS1探针在405 nm激发波长下的ΔF/F0以蓝色表示,而在488 nm波长下的ΔF/F0以绿色表示。ΔR/R0以紫色表示。每组n = 20个细胞;数据以均值±标准误(SEM)表示。
G-J Mito-ArgS1、ER-ArgS1、Lyso-ArgS1和Nuc-ArgS1对1 mM Arg灌注的最大响应。每组n = 20个细胞;数据以均值±标准误(SEM)表示。
图4 MDA-MB-231细胞中Arg的成像
A ArgS1探针在MDA-MB-231细胞中表达的示意图,包括有和无Arg饥饿条件下的情况。
B MDA-MB-231细胞和ASS1过表达的MDA-MB-231细胞中ASS1的表达水平。
C MDA-MB-231细胞(圆形)和ASS1过表达细胞(方形)在Arg饥饿(深红色)或完全DMEM对照组(黑色)处理24小时后的细胞活力。Arg饥饿组的细胞活力均归一化为完全DMEM对照组。每组n = 600个细胞(来自6个孔);数据以均值±标准误(SEM)表示。
D ArgS1探针在MDA-MB-231细胞和ASS1过表达的MDA-MB-231细胞中的荧光强度和响应变化在Arg饥饿30分钟前后成像。比例尺:10 μm。
E ArgS1探针在MDA-MB-231细胞和ASS1过表达的MDA-MB-231细胞中的488/405比率变化在Arg饥饿2小时前和24小时后每15分钟成像一次。每组n = 600个细胞(来自6个孔);数据以均值±标准误(SEM)表示。