肝硬化是一种严重的慢性肝病,其核心特征之一是门静脉高压。门静脉高压导致的肝脏血管系统损伤,会引发腹水、食管胃底静脉曲张破裂出血等一系列致命并发症,全球每年导致约120万人死亡。目前,除肝移植外,尚无FDA批准的根治性药物。长期以来,由于缺乏能够模拟肝硬化状态下血管周围复杂力学微环境的体外模型,异常静水压如何导致血管损伤的病理机制一直是领域内研究的瓶颈。
2025年11月14日,清华大学生物医学工程学院杜亚楠教授课题组在 Science Advances 杂志上发表了题为 “Hepatic hypertension on-a-chip identifies GPR116 as a hydrostatic pressure mechanosensor to regulate vascular injury in cirrhosis” 的研究论文。该研究成功开发了二维静态和三维动态“肝高压芯片”( Hepatic Hypertension-on-a-chip,HH-Chip) 模型,首次在体外模拟了肝硬化的血流动力学和基质力学特性,揭示了肝硬化进程中机械力如何驱动血管损伤的关键机制。利用这一创新平台鉴定出GPR116是肝血窦内皮细胞(LSECs)感应静水压的机械力感受器,阐明了其下游信号转导通路,进一步通过细胞疗法和基因疗法验证了靶向GPR116在延缓肝硬化进展中的治疗潜力。这一发现不仅为理解肝硬化病理提供了全新视角,更为开发针对抗血管退化而非传统抗血管生成的新型疗法开辟了道路,有望改善晚期肝硬化患者的治疗困境
“肝高压芯片”再现肝硬化复杂力学微环境
研究团队设计的HH-Chip系统,包含了2D静态和3D动态两种构型(图1)。2D静态芯片通过在PDMS压力腔内的不同刚度水凝胶上培养LSECs,并施加生理到病理范围的静水压,实现了对细胞形态、迁移和粘附等行为的精确观察。研究发现,LSECs在高刚度基质上遭遇高压时,会出现细胞数量锐减、收缩聚集等类似于肝硬化的血管退化表型。
更为精巧的3D动态芯片则通过调控I型胶原的交联度,模拟了肝硬化过程中基质粘弹性的变化,并整合流体阻力器,在维持生理剪切力的同时,精确控制管内压力。该模型成功再现了LSECs在软/硬血管中应对高压时出现不同的血管损伤反应,与2D芯片的发现及体内病理特征高度一致。
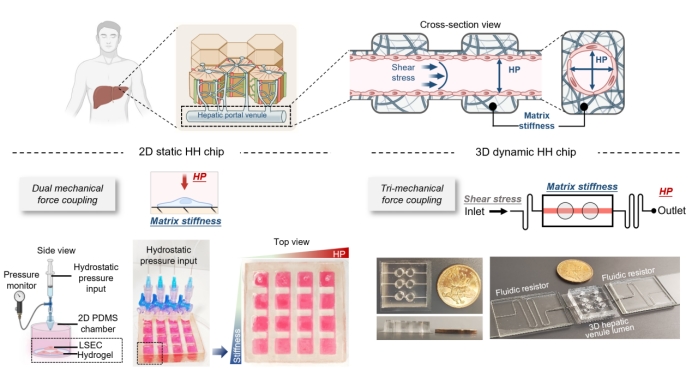
图1:肝高压芯片(HH-Chip)的设计
HH-Chip筛选并鉴定高压感知“哨兵”——GPR116
利用HH-Chip平台,进行了三阶段筛选:1)在2D芯片中筛选出高压刺激下表达趋势发生特定变化的8个膜蛋白基因;2)结合人肝硬化单细胞测序数据库,锁定在肝脏血管内皮中特异性表达的基因;3)在人和小鼠肝硬化样本中进行验证。最终发现一个此前功能未知的黏附GPCR蛋白—— GPR116是关键的压力感受器膜蛋白。
随后的功能实验证实,在LSECs中敲低GPR116后,细胞在高刚度基质和高压的联合打击下,凋亡和衰老显著减少,细胞筛孔结构得以保持,3D血管屏障完整性也得到保护(图2)。
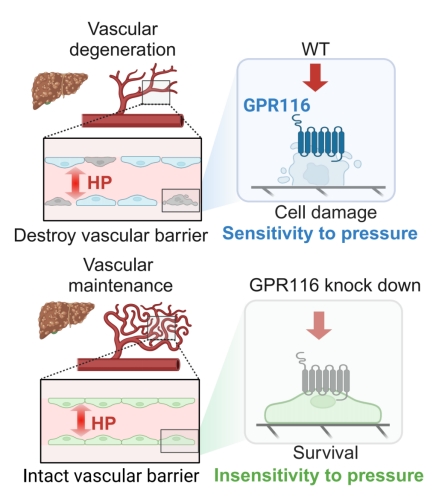
图2:GPR116作为静水压机械力感受器调控肝硬化中的血管损伤
进一步深入解析了GPR116的力感应与信号转导机制。发现GPR116特异性地响应压力变化,而非剪切力、牵拉力或基质刚度的变化。在LSECs或HEK 293T细胞中过表达GPR116,能在压力下激活下游信号;反之,敲低GPR116则能有效保护细胞免受高压诱导的损伤,而其他已知的机械传感器如PIEZO1、PIEZO2和TRPV4则不具备此特性。当感受到压力时,GPR116发生自水解,激活下游Gs信号通路,进而引发细胞骨架紊乱,并抑制PI3K/Akt信号通路和CREB蛋白的磷酸化,最终导致细胞凋亡。
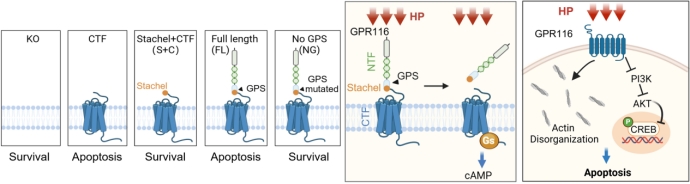
图3 GPR116进行机械感应和机械力转导的机制示意图
治疗新策略:从抗血管生成到抗血管退化
基于机制研究,团队探索了两种靶向GPR116的治疗策略。一方面,将能够抵抗高压损伤的shGPR116-LSECs经脾脏注射移植到小鼠的纤维化肝脏内,发现这些细胞能够一定程度减轻胶原沉积、促进血管化,展现了此工程化肝血窦内皮细胞疗法的前景。另一方面,在纤维化早期通过AAV2/9病毒载体递送shGpr116,成功在体内降低了GPR116的表达,并延缓了肝纤维化向晚期进展,证实了基因治疗的可行性。
当前肝硬化治疗中,非选择性β受体阻滞剂虽能降低门静脉压力,但存在导致低血压和增加死亡风险等副作用。本研究提出了范式转变的思路:针对GPR116的干预策略旨在“维护”血管健康,防止其退化,而非简单地“阻断”血管生成。GPR116作为孤儿受体,不参与调节血管的收缩与舒张,因此以其为靶点可能提供一种比现有药物更安全的降压途径。
本研究不仅为肝硬化研究提供了HH-Chip平台,克服了传统模型在模拟复杂力学微环境方面的局限,更重要的是首次揭示了GPR116作为肝脏血管特异压力机械力感受器的全新角色,并系统阐明了其在肝硬化血管损伤中的核心机制。所提出的靶向GPR116的细胞和基因治疗新策略,为肝硬化的防治开辟了新方向。值得一提的是,HH-Chip作为一个通用平台,有望广泛应用于其他高压相关疾病(如肺动脉高压、动脉粥样硬化、高血压视网膜病变和肾病变)的病理研究、靶点发现和药物筛选,展现出广泛的转化潜力。
清华大学生物医学工程学院教授、清华-北大生命联合中心研究员杜亚楠为该文章的通讯作者,清华大学生物医学工程学院博士后龙艺、博士生梁凯倪和牛宇迪为共同第一作者,北京协和医学院博士生王睿、中山大学孙逸仙医院刘睿全博士、清华大学医学院张岩博士、博士生敖艳肖、金宇虹博士、吴钊钊博士、武冰洁博士、刘志强博士,药学院博士生张欣对本研究有重要贡献。昆明医科大学第一附属医院刘斌教授,东南大学附属中大医院祁小龙教授,清华大学药学院刘翔宇教授对本研究提供了重要指导。本研究得到了国家基金委杰出青年项目、重点项目、青年项目C类(82125018,32430058,32401086),北京市自然科学基金(Z230016),中国博士后自然科学基金面上项目(2022M721862)的支持。
文章链接: https://www.science.org/doi/10.1126/sciadv.adu7596
