2025年11月21日,生命中心PI/清华大学生物医学工程学院教授杜亚楠团队在《美国国家科学院院刊》(PNAS)在线发表题为《Artificial Cells with Liquid-liquid Phase Separation-Regulated Cell-free Protein Synthesis》的研究论文。该研究开发出一种基于液-液相分离(LLPS)的物理开关实现了人工细胞(Artificial Cells)的构建和环境响应性门控。这项工作不仅展示了一种无细胞蛋白表达调控的全新策略,更为人工细胞从体外实验走向体内应用提供了初步验证。
1. 研究背景:从体外到体内的鸿沟
自下而上的合成生物学致力于通过构建人工细胞来模拟甚至超越天然细胞的功能。其中,无细胞蛋白合成(CFPS)系统因其开放、可编程的特性,成为驱动人工细胞执行任务的核心引擎。然而,如何将这些在体外试管中表现优异的人工细胞部署到复杂的体内环境中,并让其可靠地感知、响应并执行任务,是该领域面临的巨大挑战。具体而言,触发的可靠性、在体的稳定性、信号的读出方式以及合成的一致性,共同构成了巨大的挑战。
2. 为人工细胞装上物理开关——基于相分离的可逆门控
受天然细胞内一些蛋白(例如Tau蛋白)在病理条件下发生聚集导致功能异常的启发,本研究团队设计并合成了一种功能化仿生聚合物——羧乙基葡聚糖(CE-Dex)。该聚合物携带可随pH变化而改变的电荷,能够通过多价静电相互作用,可逆地诱导整个CFPS系统发生液-液相分离,形成微米级的聚集体。在聚集体状态下,蛋白合成系统被物理性关闭;而当环境pH升高至碱性时(如特定病理微环境),凝聚体能在秒级时间内迅速解离,从而开启蛋白合成(图1)。
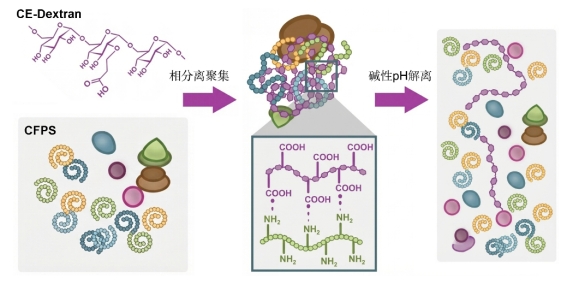
图1 CFPS在CE-Dex诱导下通过分子间作用力形成聚集体,关闭蛋白合成;在碱性pH作用下重新解离为溶液状态开启蛋白合成
这一基于生物物理原理的非遗传性开关,为精确智能调控人工细胞功能提供了全新的物理化学手段,其具有响应快速、可逆性强、开关比高等显著优势。
3. 高均一性人工细胞的微流控智造与功能化
为了承载上述聚集和解离的CFPS系统,开发出一套先进微流控工程平台,用于高通量、稳定制备巨型单层囊泡(GUV)作为人工细胞的载体框架。通过对芯片几何结构和表面亲疏水性的精细调控,该平台在低表面活性剂依赖的温和条件下,成功实现了对高渗透压CFPS体系的高效封装,制造出尺寸高度均一的GUV(图2)。
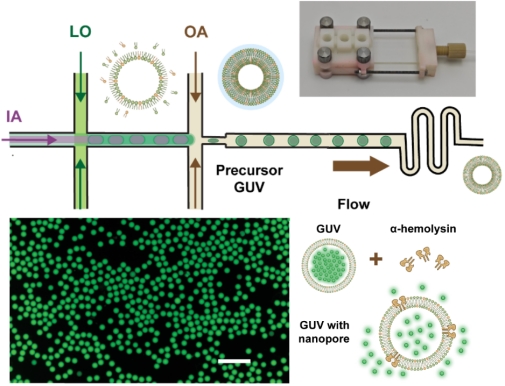
图2 基于微流控的微米囊泡制备系统,用于封装CFPS体系,并结合α-溶血素实现人工细胞的内外通讯
此外,为了让封装在内部的CFPS系统能与外界环境进行信息和物质交换(即感知pH信号、获取能量底物),在GUV膜上修饰了α-溶血素(α-HL)纳米孔道。该孔道允许离子、氨基酸等小分子自由进出,同时将内部蛋白质表达所需要的组件牢牢锁在人工细胞内部,实现了内外环境的受控通讯。
4. 相分离体系与磷脂膜的融合:在人工细胞内实现可控开关
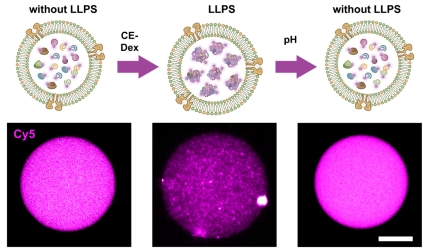
图3 人工细胞实现pH响应的CFPS系统相分离聚集和解离
成功构建了LLPS调控的CFPS系统与载体框架GUV后,一个核心的问题必须在进行体内应用前得到解答:这个精密的物理开关,在被封装进微米尺度的密闭空间后,是否还能正常工作?为回答这一问题,研究团队通过高分辨率的荧光显微镜对人工细胞的内部状态进行了直接观察,荧光标记的CFPS系统清晰地证实了聚集和解离过程(图3)。
在添加了CE-Dex诱导分子的条件下,人工细胞内部形成了明亮、致密的荧光聚体。这表明LLPS物理开关成功启动,将蛋白合成系统锁定在了休眠状态。随后,当人工细胞被转移至模拟病理微环境的碱性pH溶液中,通过预置在囊泡膜上的纳米孔道,外界的pH信号被迅速感知。显微镜下观察到,内部的荧光聚集体在极短时间内完全溶解,恢复为均匀的荧光分布。这标志着物理开关被成功打开,系统进入了唤醒状态。
这一关键的体外验证,证实了LLPS物理开关在微米尺度的受限空间内依然能够高效、可逆地工作。证明了所构建的不再仅仅是开关和载体的简单组合,而是一个功能一体化的智能人工细胞。
5. 人工细胞首次实现对体内病理微环境的精准报告
最后,本研究将这一智能人工细胞应用于真实的小鼠疾病模型中。团队建立了胆总管结扎(BDL)小鼠模型,在活体中证实该模型肝内胆管区域存在一个稳定的局部碱性微环境(pH ≈ 8.3),这为人工细胞的精准触发提供了天然靶点。
将搭载了生物发光酶报告基因的人工细胞原位注射到BDL小鼠的肝脏病灶区后,活体生物发光成像结果清晰地显示:
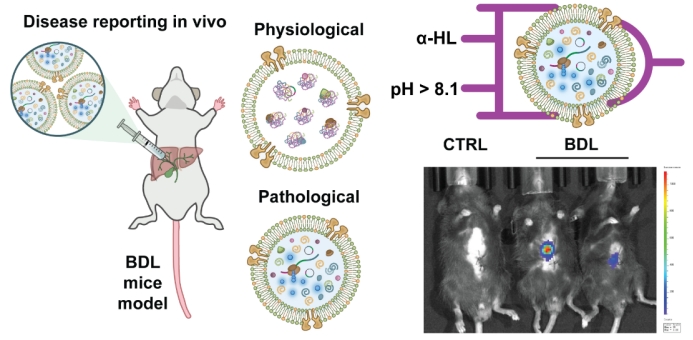
图4 人工细胞于体内可控表达以报告疾病状态
综上,该人工细胞能够作为体内微环境的检测和报告工具,在复杂的活体环境中识别疾病特异性的生化信号,并将其转化为可被无创检测的可视化信号。初步的生物安全性评估也显示,该系统具有良好的体内兼容性。
6. 研究意义与展望
本研究为基于无细胞蛋白合成系统的人工细胞在精准医疗领域的应用提供了新思路。首先,提供了一种基于物理相分离的非遗传性蛋白功能调控新策略,这种策略响应快、可逆性强,有望被应用于需要对复杂生物反应进行动态、无创控制的场景。更重要的是,首次在动物模型中验证了人工细胞作为体内诊断报告工具的可行性。未来的人工细胞侦察兵或许能被编程去感知肿瘤微环境、炎症区域等特定酶信号,从而实现对重大疾病的早期、精准定位诊断。更进一步,如果将报告蛋白替换为治疗蛋白,这类人工细胞有望化身为发现即治疗的微型智能药物工厂,为探索诊疗一体化提供了可能。
生命中心PI/清华大学生物医学工程学院教授杜亚楠为该文章的通讯作者,清华大学生物医学工程学院博士生樊东东、梁凯倪为共同第一作者;清华大学生物医学工程学院武冰洁博士、陈昊珂硕士、孙雷博士后、清华大学医学院张岩博士、清华大学生物医学工程学院孙丞域同学对本研究有重要贡献。清华大学药学院韩国福老师对本研究相关实验提供了支持。本研究得到了国家基金委杰出青年项目、重点项目(82125018,32430058)的支持。
文章链接:https://www.pnas.org/doi/10.1073/pnas.2511283122
