STING是cGAS-STING天然免疫信号通路中的关键下游接头蛋白,其相关研究近年来十分活跃。已有证据表明,PI4P信号对STING的激活至关重要,但其具体分子机制尚待明确【1,2】。此外,STING跨膜区TM2和TM3的结构调控机制——包括其间loop区的棕榈酰化修饰,以及各种内源性与合成小分子对该区域的调控方式——仍是该领域悬而未决的重要科学问题【3,4】。近年来,STING作为肿瘤免疫治疗的研究热点,其激动剂的开发在基础研究中进展显著。然而,多项STING激动剂的临床试验尚未达到预期疗效,提示未来需开展更深入的机制研究、药物优化及联合用药探索。
2025年12月5日,生命中心/清华大学药学院张从刚课题组、刘翔宇课题组与陆军军医大学陆军特色医学中心陈客宏团队合作,在《Immunity》发表了题为“A chemical agonist and the Golgi-resident lipid PI4P activate STING by inducing transmembrane helix rearrangement”的研究论文。该研究鉴定出一种新型STING激动剂GNE-6468,该分子可高效激活STING介导的天然免疫应答与非经典自噬,在细胞及动物模型中展现出潜在的抗病毒与抗肿瘤免疫治疗价值。机制研究表明,GNE-6468靶向STING跨膜区的一个全新结合口袋,并与位于STING二聚体之间的PI4P相互协同,共同诱导STING跨膜区构象变化,进而促进其多聚化及下游信号激活。

研究团队依托清华大学药学院药物技术中心平台,建立基于细胞的免疫功能筛选体系,系统筛选天然免疫激动剂。通过高通量小分子化合物筛选,鉴定出GNE-6468能在多种细胞及人源化小鼠中强烈诱导I型干扰素反应,显著激活天然免疫应答。进一步研究表明,GNE-6468可强烈激活TBK1-STING-IRF3信号通路的磷酸化,且该免疫激活效应依赖于STING和TBK1,而不依赖于cGAS,提示GNE-6468很可能是一种新型STING激动剂。
为深入阐明其作用机制,研究团队利用冷冻电镜技术成功解析了人源STING与GNE-6468复合物的高分辨率结构。结构显示,GNE-6468结合于由STING的TM2、TM3和TM4所形成的跨膜区口袋中,这是一个此前未曾被定义的崭新激动剂结合位点。GNE-6468的结合促使STING的TM3螺旋发生大幅位移,从而诱导STING多聚化与激活。令人意外的是,结构中还观察到位于STING二聚体之间的PI4P分子(经质谱鉴定确认),其发挥类似“分子胶”的作用,与GNE-6468协同激活STING天然免疫信号。基于该独特机制以及GNE-6468在TM2-TM3区域的特殊定位,研究发现STING抑制剂H-151(作用于TM2-TM3 loop)和PI4KB抑制剂(抑制PI4P生成)均能在极低浓度下有效抑制GNE-6468介导的免疫反应。这些结果从分子层面揭示了GNE-6468与PI4P协同激活STING的机制,深化了我们对PI4P免疫调控功能及STING激活机理的认识。
在机制研究基础上,团队进一步对GNE-6468的生物学功能进行了系统表征。研究发现,GNE-6468不仅能激活I型干扰素天然免疫反应,还可诱导非经典自噬,这一特性与其他靶向跨膜区的STING激动剂(如C53)明显不同。同时,研究在多种人源样本中验证了GNE-6468激活免疫反应的能力。为评估其在抗病毒与抗肿瘤免疫治疗中的潜力,团队开展了系统的功能实验,结果显示GNE-6468能以STING依赖的方式发挥强烈的抗病毒与抗肿瘤免疫效应;此外,GNE-6468与PD-1抗体联合用药也表现出显著的协同抗肿瘤效果。
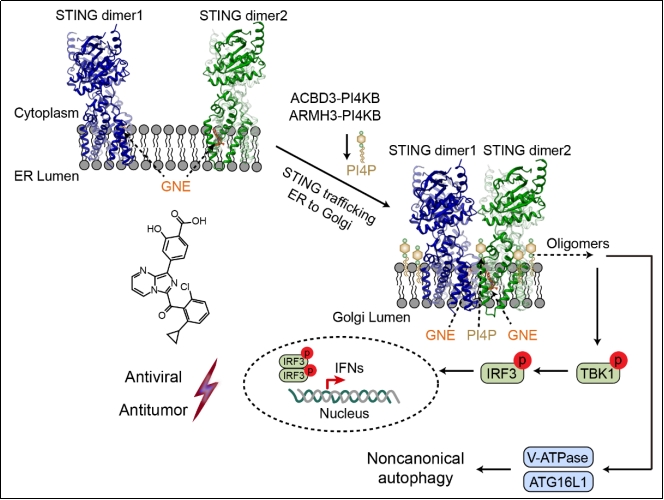
综上所述,该研究阐明GNE-6468是一种靶向全新跨膜区作用位点的新型高效STING激动剂,在抗感染与抗肿瘤治疗中具备潜在临床应用价值。同时,本研究也引发出若干值得深入探索的科学与应用问题:例如,PI4P在cGAMP介导的STING信号及其他关键免疫蛋白(如NLRP3)中的作用机制是什么?STING新发现的跨膜区结合口袋是否可被内源性配体识别?GNE-6468作为一种既能抑制IL-17(通过抑制RORγt)又能激活I型干扰素的小分子,其临床潜力如何?是否在抗疼痛、肠炎、肾炎乃至神经行为学等领域具有应用前景?
生命中心/清华大学药学院张从刚研究员、刘翔宇研究员和陆军军医大学陆军特色医学中心(大坪医院)陈客宏主任为该论文通讯作者,清华大学博士后韩晶(已出站)、博士生张书豪(已毕业)、侯燕飞和汪依为该论文第一作者。中国医学科学院曹雪涛院士、清华大学尹航教授、天津大学刘培源老师、山西医科大学彭泽旭老师等在该课题实施过程中提供了宝贵的帮助。该研究得到了北京市自然科学基金、国家自然科学基金项目、膜生物学国家重点实验室、清华-北大生命科学联合中心、北京生物结构前沿研究中心、山西医科大学-清华大学前沿医学协同创新中心、清华大学自主科研笃实专项等项目的资助支持。
原文链接:https://www.cell.com/immunity/fulltext/S1074-7613(25)00506-0
