蛋白质分泌是细胞间信息传递的核心机制之一,尤其在免疫应答和肿瘤微环境中发挥关键作用。蛋白质的翻译后修饰(PTM)广泛参与调控其功能与定位,然而,传统蛋白质组学方法难以精确捕捉携带特定修饰的蛋白质在分泌过程中的时空动态。现有邻近标记技术虽能追踪蛋白质分泌,却无法区分不同修饰形式的蛋白质,限制了人们对PTM在细胞通讯中功能的理解。
2025年 12月 4日,生命科学联合中心、清华大学药学院秦为课题组与中国药科大学庄申甜团队合作,在《Nature Communications》上发表题为“Spatiotemporal profiling of modification-specific proteome secretion uncovers an itaconation-activated tyrosine kinase”的研究论文。该研究发展了一种名为“PTM-based secretome profiling(PBSP)”的新型化学蛋白质组学技术,实现了对携带特定翻译后修饰的分泌蛋白的时空动态追踪,并揭示了衣康酸修饰通过激活酪氨酸激酶FYN调控细胞间通讯的新机制。随后该工作被《Nature Chemical Biology》杂志主编Russell Johnson选为当月“Research Highlight”文章。

PBSP 的核心设计基于“脉冲-追踪”策略:研究人员首先利用带有生物正交基团的探针(如衣康酸探针ITalk)对活细胞内的蛋白进行脉冲标记,随后洗去探针并进行一段时间的追踪培养,最后从培养基中富集被标记的分泌蛋白质并进行鉴定。该方法结合了基于C18 tip的低损耗富集纯化技术(FISAP)与数据非依赖采集(DIA)质谱策略,显著提高了检测灵敏度与覆盖度(图1)。该技术不仅具备高时空分辨率,还可适配多种PTM类型,包括糖基化、羰基化、琥珀酸化等。
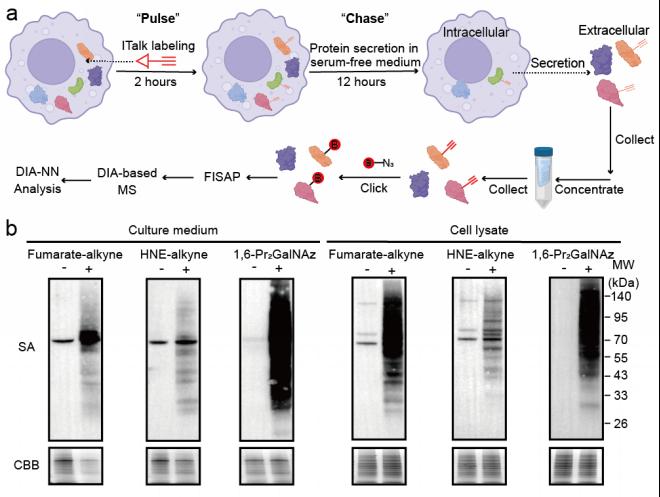
图1. (a)PBSP技术流程示意图; (b)PBSP在多种PTM分泌蛋白检测中的应用
该研究在巨噬细胞模型中成功鉴定出818个衣康酸修饰的分泌蛋白,其中447个为外泌体依赖性分泌。尤为突出的是,研究人员发现酪氨酸激酶FYN在Cys239位点发生衣康酸修饰,该修饰通过抑制其Tyr531位点的磷酸化,增强FYN激酶活性,并促进其通过外泌体分泌至胞外(图2)。最后,PBSP凭借其PTM特异性与高灵敏度优势,被成功应用于多种PTM介导的分泌过程研究。
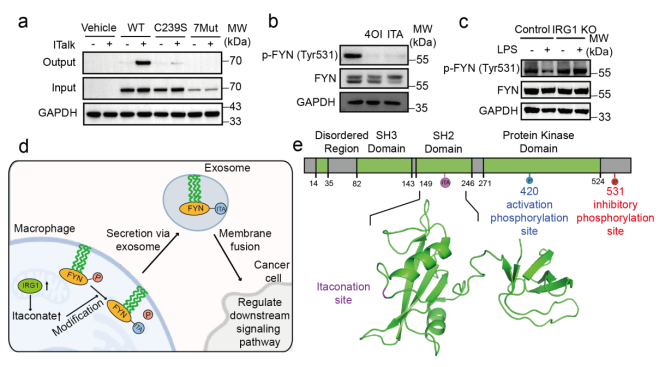
图2. FYN激酶在Cys239位点的衣康酸修饰增强其活性
此外,研究还展示了PBSP平台的可拓展性,通过替换不同PTM探针(如富马酸探针、糖基化探针等),成功实现了对多种PTM特异性分泌蛋白的系统性解析。
综上,PBSP通过生物正交标记与时空分辨策略,首次实现了对PTM特异性分泌蛋白组的动态解析,突破了传统分泌组学技术在PTM分辨能力上的限制。该技术不仅为理解代谢物调控的蛋白质分泌与细胞间通讯提供了新工具,也为免疫调节、肿瘤微环境等研究领域提供了全新的分子视角。
生命中心、清华大学药学院秦为助理教授和中国药科大学庄申甜副教授为本文共同通讯作者。清华大学药学院博士生陆文捷和博士后张艳玲为论文的第一作者。中国药科大学倪欣睿,王翩为本文提供了重要实验帮助。秦为课题组得到了国家高层次海外人才计划,国家重点研发计划青年科学家项目,国家自然科学基金重大研究计划培育项目,面上项目,青年基金项目,中国博士后面上项目,北京市自然科学基金青年科学基金重点项目,清华-北大生命科学联合中心,清华大学笃实计划,北京生物结构前沿研究中心,北京分子科学国家研究中心开放课题基金,深圳市医学研究基金等基金支持。
原文链接:
https://www.nature.com/articles/s41467-025-66508-y
