近年来,深度学习结构光照明显微镜技术在长时程超分辨活细胞成像中展现出巨大潜力,为揭示亚细胞结构的动态过程与相互作用提供了强大工具。然而,现有方法严重依赖大量高质量“真值”图像进行监督训练,这些数据在光敏感、快速变化的生命过程中极难获取,限制了该技术的普适性。此外,主流端到端神经网络往往忽视超分辨成像物理模型,导致在低信噪比条件下重建保真度与分辨率下降。
针对上述挑战,2025年12月12日,生命中心/清华大学李栋课题组、华中科技大学谭山课题组和复旦大学刘妍君课题组在《自然·方法》(Nature Methods)上联合发表题为“基于自监督重建的生物友好型高精度结构光超分辨显微成像”(Bio-friendly and high-precision super-resolution imaging through self-supervised reconstruction structured illumination microscopy)的长文(Article)。该工作提出了自监督重建结构光照明显微术(SSR-SIM),创新性地将重建伪影的统计分析与结构光照明的物理先验深度融合,无需采集任何真值图像数据即可实现媲美有监督学习的高精度、高保真超分辨图像重建,从根本上摆脱了深度学习显微成像对于配对训练数据的依赖,并首次揭示了细胞间纳米管通讯、病毒与宿主细胞互作等光敏感和小概率生物学过程的动态变化。
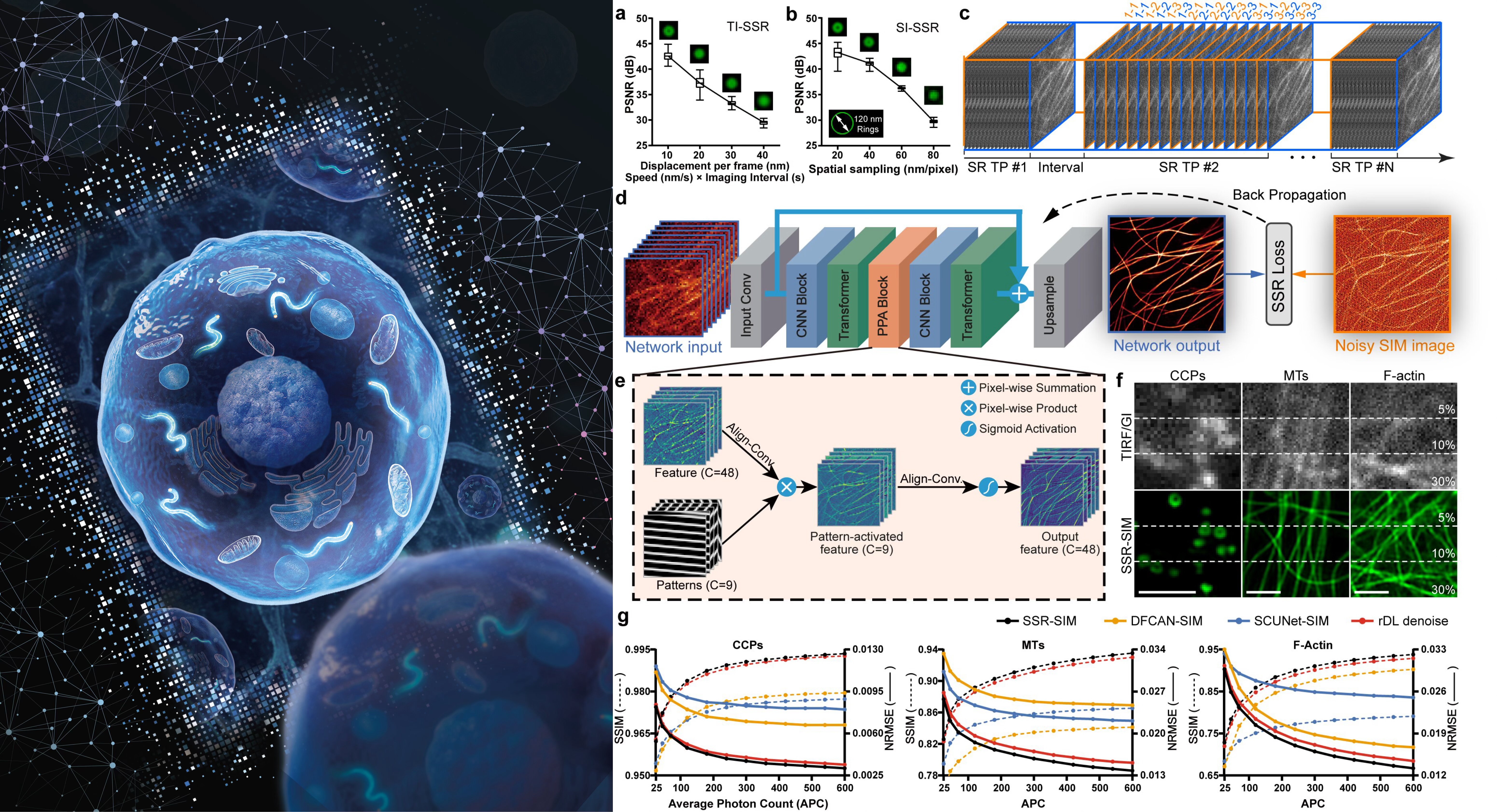
图一 SSR-SIM学习框架及神经网络架构
技术原理:融合物理光学先验的自监督学习框架
研究团队首先系统分析了现有自监督算法在活细胞SIM成像中的失效原因。研究发现,SIM重建伪影具有长距离空间相关性,而活细胞快速运动导致时间间隔采样数据的信号一致性缺失,进而导致现有基于空间或时间采样的自监督方法产生高频信息复原不全,超分辨精度受限的结果。
为此,研究团队提出一种硬件层面的 “信号一致成像序列”解决方案。该方案通过精确控制照明序列,同时采集两组具有相同生物信号与照明模式、但噪声相互独立的原始图像,从而满足自监督学习有效性的核心假设(信号一致、噪声独立)。基于此,该团队构建了全新的自监督重建损失函数,并从理论上证明,在该自监督框架下训练的模型能够实现与有监督模型相当的重建精度。
在网络设计方面,研究团队并未简单采用“黑箱”式端到端网络,而是率先开发了物理光学先验混合卷积与Transformer架构(PHCT)。该架构兼具局部特征建模的优势(卷积神经网络)与远程像素依赖关系建模的能力(Transformer模块),特别适用于大视场成像。其核心创新在于开发了物理先验引导的模式激活(PPA)模块,该模块将结构光调制的频率信息先验显式编码到网络中,显著增强了对高数值孔径下密集照明条纹的解调能力,从而能够更完整地恢复图像的高频超分辨信息。
技术优势:精度领先、生物友好、高效易用
在公开基准数据集上的系统评测表明,SSR-SIM在峰值信噪比(PSNR)、结构相似性(SSIM)等定量指标上均优于现有的非学习型、有监督及无监督学习SIM算法,且在不同荧光光子数条件下表现稳健。
该方法展现出卓越的生物友好性。通过钙离子荧光指示剂监测,证实SSR-SIM成像引起的细胞应激反应与阴性对照组相当,显著低于传统SIM,为实现长时程活细胞观测提供了保障。此外,该方法仅需极少训练数据(可低至5对原始图像),网络参数量小(最低仅0.33M),重建速度快(如处理512×512图像约17毫秒),可满足实时处理需求。集成的蒙特卡洛Dropout层还能提供模型不确定性估计,为用户评估重建结果可靠性提供依据。
创新发现:揭示前所未有的生命动态细节
凭借高时空分辨率、低光毒性和长时程成像能力,SSR-SIM成功应用于多种极具挑战性的活细胞场景中,并揭示了系列新颖生物学现象:
细胞器与细胞骨架动态:支持超过四小时及10000个成像时间点的肌动蛋白骨架的持续重塑的超分辨成像,清晰记录线粒体嵴的穿透、分裂、融合与旋转超过2000个时间点。
蛋白质转运新机制:以超分辨精度实时观察到病毒糖蛋白(VSVG)和内质网(ER)互作,发现VSVG运动可导致内质网片层发生分裂,观察内质网搭便车协助VSVG转运。
内吞循环过程解析:连续记录超过1500个时间点,清晰分辨了Rab11a与转铁蛋白受体在运输过程中呈现的管状与盘状两种形态,并揭示了信号消失的先后顺序。
痘类病毒传播新见解:对痘苗病毒诱导产生,以辅助其传播的肌动蛋白彗星尾进行超分辨成像,首次发现其为“中空”且常具“多尾”的复杂结构,颠覆了传统认知。
细胞间通讯观测:对隧道纳米管(TNT)中传输的线粒体进行长达3小时以上的成像,发现线粒体在TNT中运输时仍能发生分裂事件。
三维动态超分辨成像:拓展的SSR-3D-SIM技术能在极低光照下,对线粒体网络等进行高保真三维体成像,并记录其动态重构过程。
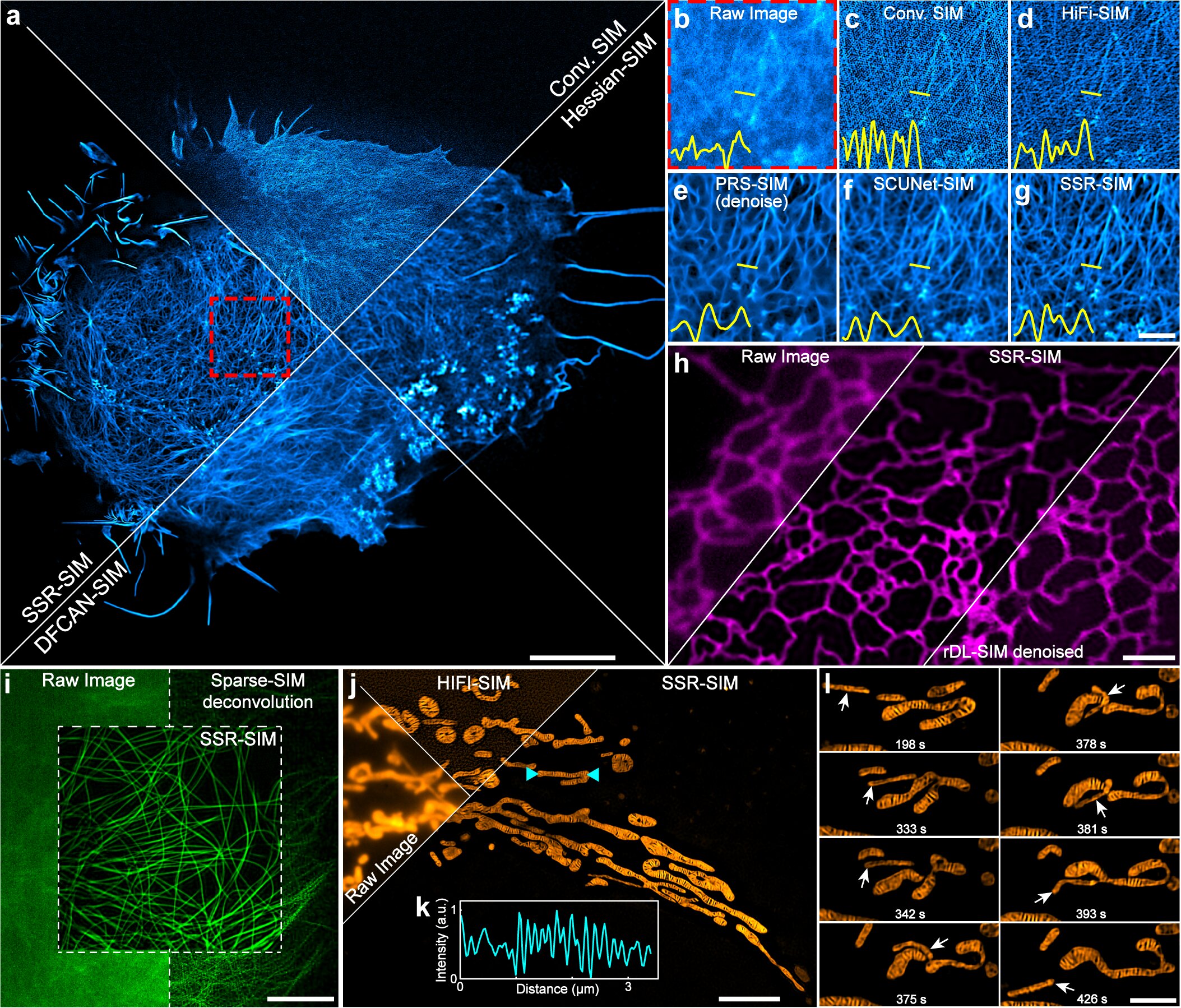
图二 SSR-SIM成像常见亚细胞结构
总结与展望
李栋、谭山、刘妍君合作团队通过人工智能算法与光学显微成像物理模型的深度交叉融合,成功开发了SSR-SIM技术。该工作不仅从根本上解决了深度学习SIM对真值数据的依赖问题,还通过引入物理先验显著提升了重建的保真度与通用性。
综上,所提出的SSR-SIM技术将SIM技术固有的高速、低光毒性、多色兼容等优势,进一步拓展至更广泛、更敏感的活体生物样本和动态过程研究中。该技术有望成为细胞生物学、病毒学、神经科学等领域探索复杂生命过程的常规利器。这项研究也为计算显微成像领域的发展提供了新范式,即通过算法与物理的紧密结合,以更智能、更友好的方式揭开生命微观世界的神秘面纱。
华中科技大学人工智能与自动化学院博士生刘嘉浩和刘涛、清华大学膜生物学全国重点实验室助理研究员董学、中科院生物物理研究所博士后陆怀德、复旦大学生物医学研究院博士后刘伟为共同第一作者,生命中心/清华大学生命科学学院李栋教授,华中科技大学人工智能与自动化学院谭山教授,复旦大学生物医学研究院刘妍君教授为共同通讯作者。本研究得到了国家自然科学基金委、科技部、腾讯“新基石”基金的资助。
文章链接:https://www.nature.com/articles/s41592-025-02966-y
