树突状细胞(Dendritic Cells, DCs)作为专职抗原提呈细胞,在启动抗肿瘤免疫应答中发挥着核心作用。然而,在肿瘤微环境中,DC的功能往往受到抑制。Toll样受体(TLR)激动剂能够模拟危险信号,促进DC成熟和活化,是极具潜力的免疫佐剂。尽管经典的TLR2激动剂(如Pam3CSK4)已被广泛研究,但其在体内的稳定性和抗肿瘤效力仍有待提升。因此,开发更高效、稳定的新型TLR2激动剂,并探索其调节DC功能的分子机制及联合用药策略,对于肿瘤免疫治疗具有重要意义。
研究团队首先在B16F10黑色素瘤、MC38结肠癌和4T1乳腺癌等多种小鼠肿瘤模型中,评估了新型TLR2激动剂SUP3的抗肿瘤效果。结果显示,与经典激动剂Pam3CSK4相比,SUP3能更显著地抑制肿瘤生长和肺部转移,且在有效剂量下未引起明显的系统性炎症风暴或器官毒性。进一步的机制研究表明,SUP3的抗肿瘤效应严格依赖于CD8+ T细胞和宿主的TLR2/MyD88信号通路。进一步的细胞亚群分析及机制研究发现,SUP3主要作用于肿瘤微环境中的CD103+ cDC1亚群,并且是通过上调GTPase Rab7表达,抑制溶酶体酸化来延缓胞内抗原降解进而促进cDC1抗原交叉提呈。
值得注意的是,研究团队发现SUP3在促进DC成熟(上调CD40, CD80, CD86)的同时,也诱导了免疫检查点分子PD-L1在DC表面的高表达。DC上高表达的PD-L1会抑制T细胞的杀伤功能,这提示单独使用SUP3可能受到自身诱导的免疫抑制反馈的限制。实验数据也证实,联合使用抗PD-L1抗体可以阻断这一负反馈环路,与SUP3产生显著的协同抗肿瘤效应。
为了进一步扩大抗肿瘤免疫应答,研究团队引入了能够促进DC前体增殖和分化的细胞因子Flt3L。研究发现,Flt3L增加了肿瘤组织中cDC1的浸润丰度,为SUP3提供了更多的作用靶点。最终,“SUP3+抗PD-L1抗体+Flt3L”的三联合疗法在黑色素瘤及乳腺癌模型中展现出了最强的抗肿瘤效果,显著增加了肿瘤浸润的IFN-γ+ CD8+ T细胞比例,并有效遏制了肿瘤的生长和转移。
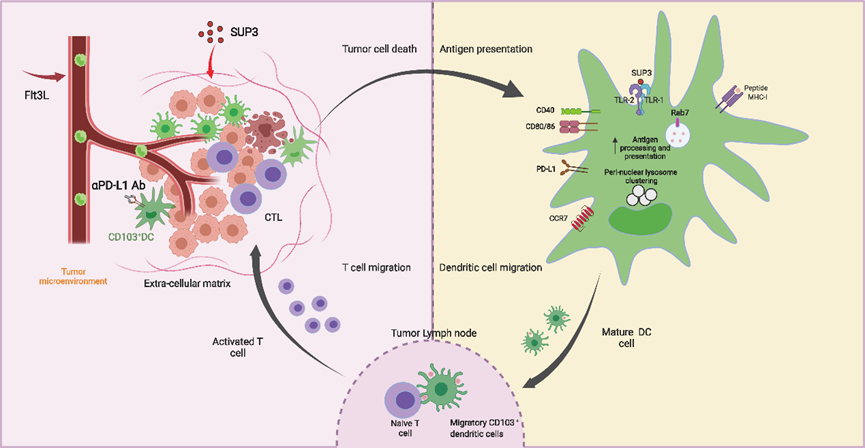
SUP3联合PD-L1阻断剂及Flt3抗肿瘤免疫模式图
综上所述,该研究不仅设计出具有临床转化潜力的新型TLR2激动剂SUP3,并深入解析了其通过Rab7调控增强抗原交叉提呈的精细机制。同时,研究揭示了TLR2激动剂诱导DC表达PD-L1的负反馈机制,为设计基于“激动剂(SUP3)+检查点阻断(抗PD-L1抗体)+细胞因子(Flt3L)”的联合免疫治疗方案提供了坚实依据。
该研究成果以“Enhancing anti-tumour immunity through modulating dendritic cell activation by combination therapy with a novel TLR2 agonist and PD-L1 Blockade”为题在Journal of Experimental & Clinical Cancer Research在线发表。

清华大学基础医学院免疫学研究所博士毕业生王超、药学院博士毕业生艾振康及基础医学院免疫学研究所2020级博士生王源浩为本文的共同第一作者。吴励教授团队的清华大学基础医学院-附属第一医院双聘项目吴韬博士,已毕业博士生罗茂财、刘鑫、吕娇燕、郭学恒,生命学院已出站博士后王迪、药学院博士毕业生王志松也为本研究做出重要贡献。该研究得到了国家自然科学基金、科技部国家重点研发计划以及清华-北大生命科学联合中心(CLS)的资助。
原文链接
https://link.springer.com/article/10.1186/s13046-025-03571-9
