G蛋白偶联受体(GPCRs)是人体基因组中成员最多的膜蛋白受体超家族,也是药物研发中最关键的靶点之一。这些受体遍布各类细胞表面,感知多种胞外信号,并启动复杂的下游信号级联反应。GPCR激活后主要招募下游两类信号转导蛋白:G蛋白与β-arrestin蛋白。前期研究表明这二者结合于受体胞内同一区域,呈现竞争关系,并分别介导不同的生理效应。β-arrestin的结合不仅会阻断G蛋白信号传导,还会诱导受体内吞。在一些情况下,两条通路均被激活可能导致“在靶”副作用。典型例子包括阿片类镇痛药物(如吗啡):其镇痛效果依赖于G蛋白通路,而β-arrestin通路则可能引发药物耐受等问题。为了解决“在靶”副作用问题,科学家们尝试开发“偏向激动剂”,即选择性激活其中一条信号通路而非另一条的激动剂。这一研究思路建立在G蛋白与β-arrestin 信号通路的“非此即彼”的竞争关系之上。研究者们一直在探索是否存在GPCR活性调节的新模式,以推动下一代GPCR药物的开发。
2026年1月27日,生命中心、清华大学药学院、北京生物结构研究中心刘翔宇课题组在《细胞》(Cell)在线发表重要研究成果,题为《通用型别构激动剂稳定的GPCR-G蛋白-β-arrestin超级复合物》(A GPCR-G protein-β-arrestin megacomplex enabled by a versatile allosteric modulator)。该研究通过自主建立的新型GPCR药物筛选平台(SPS方法),首次发现艾滋病临床药物阿扎那韦是一种可作用于多种GPCR的通用型正向别构调节剂(pan-positive allosteric modulator,pan-PAM),并能介导G蛋白信号的持续激活。冷冻电镜结构进一步表明,阿扎那韦如同“分子胶水”,促成GPCR、G蛋白与β-arrestin三者形成超级复合物,使原本对立的G蛋白与β-arrestin信号通路实现“化敌为友”的共存。这项工作拓展了对GPCR信号调控的理解,为创新药物开发提供了全新视角。
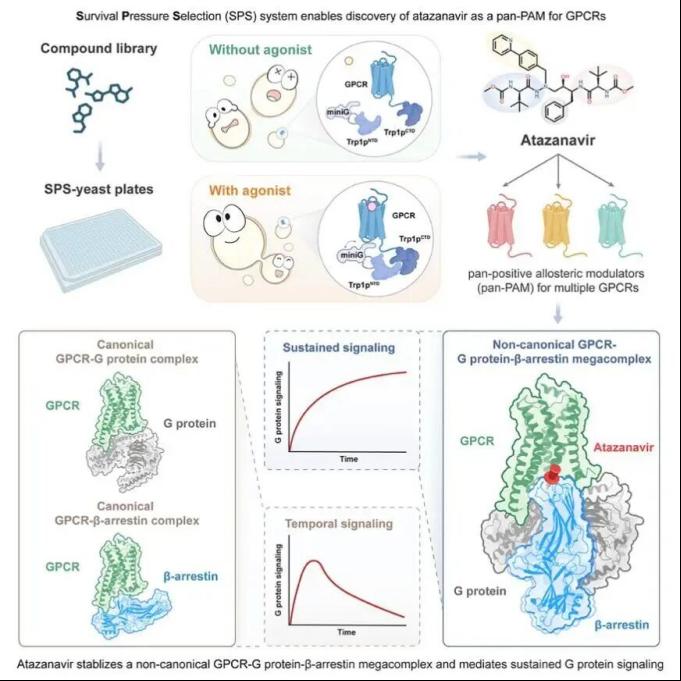
开发基于酵母生存压力的SPS系统
研究团队首先在酿酒酵母中构建了一种新型GPCR激动剂筛选系统。他们基于GPCR与G蛋白间的相互作用方式,将酵母色氨酸合成关键酶Trp1p拆分为两段,分别融合至GPCR和miniG蛋白。在GPCR未被激活的状态下,酵母因无法组装完整Trp1p而不能合成色氨酸,生长严重受限;一旦GPCR被激活,miniG被招募至受体附近,促使Trp1p组装完整,恢复色氨酸合成并加速生长。因此,通过监测酵母生长速率即可判断GPCR是否被激活。因为该系统利用生长压力开展GPCR激动剂筛选,故而被命名为“生存压力选择系统”(Survival Pressure Selection, SPS,图1)。
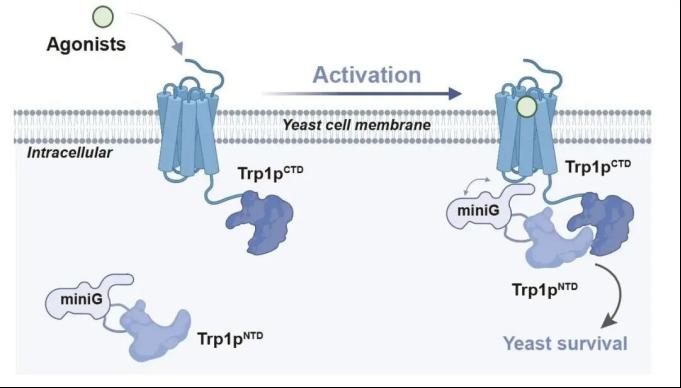
图1:SPS 方法设计示意图
利用SPS方法发现阿扎那韦为多个GPCR的通用型正向别构调节剂
利用SPS方法,研究人员对二型糖尿病潜在靶点GPR119进行了激动剂筛选,鉴定出阿扎那韦为其新型激动剂。冷冻电镜结构显示,阿扎那韦作为别构调节物结合于受体第六和第七个跨膜螺旋(TM6/7)的附近,并识别TM6的外摆构象。该构象变化是不同GPCR家族蛋白激活的共同特征。序列比对进一步表明,该结合口袋在GPCR中较为保守,提示阿扎那韦可能具有广谱活性。后续实验验证,它能广泛激活包括肾上腺素受体、阿片类受体和毒蕈碱乙酰胆碱受体在内的多种GPCR,并与正构激动剂产生协同作用,因此被称为通用型正向别构调节剂 pan-PAM。研究人员还解析了阿扎那韦结合β1肾上腺素受体与Gs蛋白复合物的冷冻电镜结构,确认其结合位点与GPR119中一致。
阿扎那韦诱导GPCR-G蛋白- β-arrestin超级复合物的形成并介导受体持续激活
深入药理学研究发现,阿扎那韦激活的G蛋白信号可持续增强超过60分钟,显著区别于传统激动剂的瞬时响应。最初研究团队怀疑阿扎那韦可能具有G蛋白偏向性:不招募β-arrestin蛋白,从而避免β-arrestin介导的G蛋白信号终止。但是实验结果明确表明该化合物同样高效介导β-arrestin的招募。这表明在阿扎那韦存在的情况下,受体招募β-arrestin的同时还可以持续激活G蛋白,提示这两类信号传导蛋白可能同时结合于受体附近,这明显不同于传统竞争模型。
此前,杜克大学 Robert J. Lefkowitz 教授团队在 2016 年和 2019 年的研究中首次报道了 GPCR-G 蛋白-β-arrestin 三元超级复合物(megacomplex)的存在。他们发现,B 类 GPCR(Class B GPCR)因其羧基端富含磷酸化位点,能够以高亲和力通过“尾部结合”(Tail engagement)方式稳定捕获 β-arrestin。在这种结合模式下,β-arrestin 与 G 蛋白分别占据受体的不同区域,从而实现二者共存,并支持 G 蛋白信号的持续激活。然而这一机制高度依赖于 B 类 GPCR 的羧基端丰富的磷酸化位点。而本研究涉及的所有靶点(包括β1肾上腺素受体、阿片受体等)均属于A类 GPCR,缺乏对 β-arrestin 的高亲和力,理论上无法以类似机制形成超级复合物。那么,是否阿扎那韦具有特殊药理性质,能够在A类GPCR中也介导超级复合物的形成呢?研究人员通过一系列共定位实验发现,阿扎那韦确实能够以某种未知的方式促进β-arrestin和 G 蛋白同时结合在受体附近。这种作用方式既不干扰 G 蛋白的结合,又能阻止信号脱敏,从而实现G蛋白通路的持续激活。
冷冻电镜结构揭示阿扎那韦以分子胶模式介导超级复合物的组装
为了阐明阿扎那韦如何实现G蛋白与β-arrestin在A类GPCR上的共存,研究团队尝试解析GPCR–G protein–β-arrestin超级复合物的高分辨率结构。然而,这一任务面临多重挑战:首先,β-arrestin与GPCR之间的亲和力很低,二者结合短暂且不稳定;其次,该复合物具有高度的动态性和异质性,极大增加了冷冻电镜三维重构的难度。面对这些困难,研究人员系统优化了蛋白表达体系、复合物组装条件及样品制备流程,并尝试多种先进的数据处理策略,最终成功获得了分辨率达3.2 Å的高质量冷冻电镜结构。
该结构首次清晰地揭示了阿扎那韦介导的三元复合物组装方式。结果显示,G蛋白依然占据受体胞内侧的经典结合口袋。而β-arrestin则是通过阿扎那韦的锚定作用,以一种前所未见的“单摆构象”(pendulum conformation)直接结合在受体第六与第七跨膜螺旋(TM6/7)的附近。在这种构象下,β-arrestin的核心结构域贴近受体近膜端,但其朝向和接触面与B类GPCR中观察到的“尾部结合”模式截然不同,也不同于任何已报道的GPCR–β-arrestin相互作用形式。阿扎那韦以“分子胶水”的方式结合在GPCR和β-arrestin共同组成的口袋里面,促进了二者的直接结合。
综上所述,本研究通过自主研发的“生存压力筛选系统”(SPS)高通量筛选平台,成功实现“老药新用”, 从已上市的临床药物库中挖掘出抗艾滋病药物阿扎那韦作为GPCR通用型正向别构调节剂(pan-PAM)。该分子通过稳定GPCR-G蛋白-β-arrestin超级复合物,实现G蛋白信号的持续激活。这一工作不仅为理解GPCR信号转导的复杂性提供了全新的视角,更提出了一条超越“偏向激动剂”策略的药物设计新思路。传统观点将GPCR下游的G蛋白和β-arrestin蛋白视为竞争关系,如同拔河比赛的双方。在这个理念下,平衡激动剂(Balanced Agonist)让双方势均力敌,而偏向激动剂(Biased Agonist)则让其中一方占据上风,不过本质上这两条信号通路还是彼此对抗的状态。与之不同,本研究揭示了一种全新的非竞争模式,其中G蛋白和β-arrestin蛋白“化敌为友”,携手调控下游信号。研究者们将其命名为桥接信号转导(Bridged Signaling)(图2)。在后续研究中,基于阿扎那韦的分子骨架进行结构优化,有望催生一类具有持续信号输出和低耐受性的GPCR靶向药物。
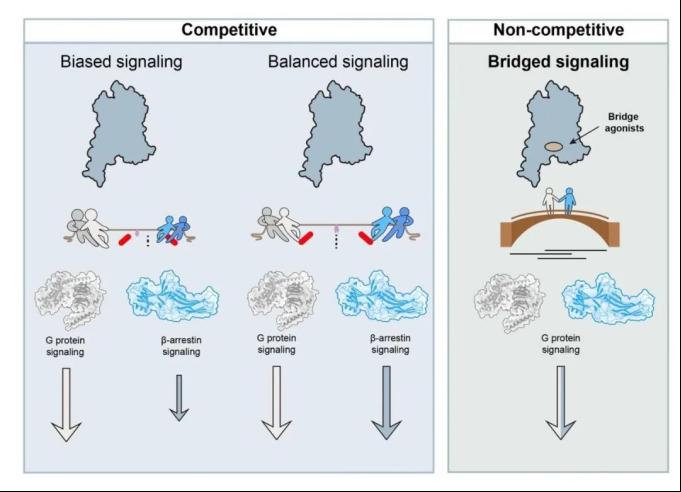
图2:桥接信号转导模式图
生命中心、清华大学药学院刘翔宇副教授课题组博士后何国栋博士,博士生孙沁心,已出站博士后许心宇博士(现为加州大学旧金山分校博士后)为本研究的第一作者。许心宇博士和刘翔宇副教授为本研究的通讯作者。刘翔宇课题组原成员张书豪博士(现为斯坦福大学博士后)和孙晓鸥博士为研究做出了重要贡献。清华大学生命科学学院闫创业副教授和孔方博士(现为西湖大学博士后)为冷冻电镜数据处理提供了重要建议和帮助。沈阳药科大学无涯创新学院林斌副教授在分子动力学模拟方面提供了重要帮助。常州大学药学院陈新教授和硕士生叶苛欣在小分子合成方面提供了重要帮助。本研究得到了国家自然科学基金委,北京市生物结构前沿研究中心,清华大学-北京大学生命科学联合中心以及清华大学笃实专项的资助。国家蛋白质科学中心(北京)清华大学分中心冷冻电镜平台、蛋白质化学与组学平台,清华大学药学技术中心,北京水木未来生物科技公司为本研究提供了重要技术支持。斯坦福大学Brian Kobilka教授以及清华大学基础医学院已出站博士后衡杰博士(现为百济神州科学家)为本工作提供了重要建议,本研究使用的 NanoBiT系统相关质粒由日本京都大学/东北大学 Asuka Inoue教授馈赠。
原文链接:
https://www.cell.com/cell/abstract/S0092-8674(25)01436-9?sessionid=315278510
