
【学术笔记】 2型糖尿病患者胰岛β细胞的身份特性及其缺失
记录人:张宝怡 陈良怡实验室
2025年8月26日上午,受北京大学-清华大学生命科学联合中心的陈良怡研究员邀请,国际糖尿病与代谢研究的顶尖专家,英国伦敦帝国理工学院Guy A Rutter教授在北京大学生命科学学院邓佑才报告厅为我们带来了一场题为“Pancreatic β cell identity and its loss in type 2 diabetes”的精彩报告。

近些年来糖尿病在人群中的发病率持续攀升,已成为全球性的重大公共卫生挑战。2型糖尿病是糖尿病的主要类型,它主要是由胰岛素抵抗和胰岛β细胞功能异常导致。因此,开发以胰岛β细胞为核心、基于精准医学理念的治疗方法具有十分重要的应用价值。
传统观点认为,2型糖尿病的发生主要源于胰岛β细胞数量的大幅减少。然而,Rutter教授在本次讲座中指出疾病的核心机制并非单纯的数量丧失,而是β细胞身份特征的改变和功能失调所导致的胰岛素分泌障碍。他首先系统阐述了β细胞响应葡萄糖并分泌胰岛素的基本过程:葡萄糖通过细胞膜上的葡萄糖转运蛋白进入β细胞内部,经过三羧酸循环等代谢过程,最终产生ATP。细胞内ATP水平的升高抑制了ATP敏感型钾离子通道的活性,引起细胞膜去极化,进而激活电压门控性钙离子通道,促使钙离子大量内流。胞内钙离子浓度的显著升高最终触发胰岛素储存颗粒的胞吐作用,将胰岛素释放入血。
在对疾病核心机制的探索过程中,他们团队发现与β细胞身份维持相关的关键基因如RFX6、PAX6,microRNA如miR125b等参与2型糖尿病的发生。此外他们团队观察鉴定到了β细胞异质性,证实了正常胰岛是一个由“Leader cells”和“follower cells”组成的功能性层级网络,能够高效协调输出胰岛素。在2型糖尿病中这种连接丧失,β细胞群体的钙信号和胰岛素分泌变得混乱、低效、失去脉冲节律。最后在精准医疗层面,他们的团队还利用全基因组测序(GWAS)筛选出了2型糖尿病的遗传学StarD10、FCHSD2、HNF1ApA251T和生物标志物如NogoR等。
Rutter团队的研究深刻揭示了β细胞特有的功能身份、细胞间异质性以及彼此连接形成的功能网络在维持血糖稳态中发挥的作用,这一精密系统的失调是糖尿病发生的主要原因。在精准医疗的发展进程中,其团队还通过系统筛选,确定了多种与2型糖尿病相关的遗传风险位点及潜在生物标志物,为开发疾病早期预警、分型诊断和靶向治疗手段提供了重要支持。
一、胰岛β细胞响应葡萄糖
首先Rutter教授详细介绍了胰岛β细胞如何响应葡萄糖。β细胞表面没有葡萄糖感应受体,葡萄糖进入β细胞依赖葡萄糖转运蛋白。进入胞内的葡萄糖会通过三羧酸循环氧化代谢,生成大量的ATP。当ATP水平上升到一定阈值时,会抑制β细胞膜上的钾离子通道,导致细胞膜电位发生改变。膜电位去极化会直接激活β细胞膜上的钙离子通道。教授强调,钙通道对膜电位变化高度敏感,去极化发生后会快速开放,使细胞外的钙离子大量流入细胞内。细胞内钙离子浓度迅速升高会促使胰岛素储存颗粒向细胞膜移动并与膜融合,最终将胰岛素通过胞吐作用释放到血液中,完成对葡萄糖的完整响应(图一)。
图一 胰岛β细胞如何响应葡萄糖
二、胰岛β细胞身份维持
接下来Rutter教授对2型糖尿病的病理过程进行了探讨。研究发现,疾病的核心机制并非传统认为的β细胞大量损失,而是其身份转变与功能失调(图二)。研究表明,患者与细胞身份维持相关的靶点(如RFX6、Pack6、miR125b)出现异常,β细胞中胰岛素表达显著降低(图三到五)。后续他们团队利用一系列分子生物学手段证实了上述位点在疾病发生过程中的重要作用。
图三 RFX6对胰岛“Disallowed Gene”的调节作用
图五 miR125b在β细胞身份维持和胰岛素分泌中的作用
三、胰岛β细胞异质性
值得关注的是,Rutter教授还介绍了β细胞具有显著的异质性,他们团队利用先进的成像技术和分析方法鉴定出β细胞具有多个功能特化的亚群,它们共同形成有层级的功能连接网络(图六)。并且他们进一步证实层级网络极大依赖于细胞间的连接,这种连接使得胰岛细胞产生同步且稳健的钙离子振荡,实现脉冲式的胰岛分泌,将少数关键细胞的优势特性放大为整个组织器官的协调输出,充分的整合了群体优势。同时他们团队的研究结果表明GLP-1可以恢复2型糖尿病患者胰岛细胞连接。这一发现为糖尿病治疗提供了新的潜在靶点(图七)。
图七 GLP-1增强细胞间连接
四、2型糖尿病全基因组测序
在精准医疗层面,Rutter教授强调了遗传学和生物标志物的重要性。2型糖尿病具有很高的遗传倾向。他们团队利用全基因组关联研究(GWAS),并通过实验的探索验证,定位了多个糖尿病风险位点如StarD10、FCHSD2、HNF1ApA251T和生物标志物NogoR(图八到十)。
图九 StarD10和FCHSD2敲除后胰岛素分泌情况
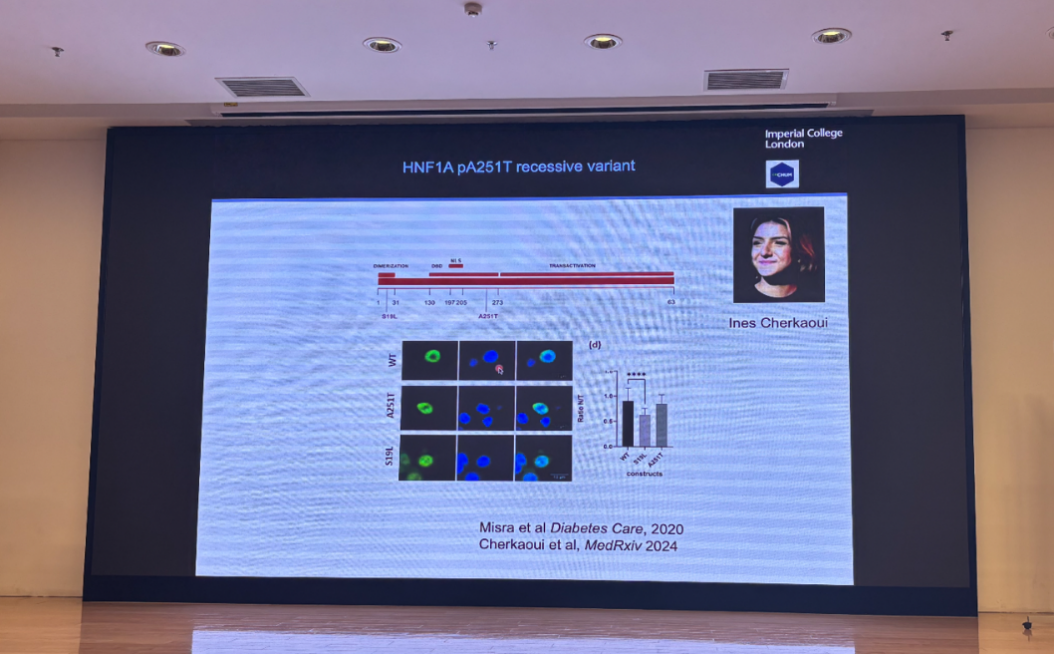
图十 2型糖尿病中HNF1ApA251T的隐形突变
此次Guy A Rutter教授的学术分享,不仅系统梳理了β细胞研究的最新进展,更提出了细胞身份调控、群体异质性、精准靶向等创新研究方向,为全球糖尿病基础研究与临床治疗提供了重要参考。未来,随着对β细胞功能机制的深入探索与精准医疗技术的不断发展,有望为糖尿病患者带来更高效、更具针对性的治疗方案,助力缓解全球糖尿病疾病负担。
参考文献
1.Cheung, R. et al. Glucose-Dependent miR-125b Is a Negative Regulator of beta-Cell Function. Diabetes 71, 1525-1545, doi:10.2337/db21-0803 (2022).
2.Carrat, G. R. et al. Decreased STARD10 Expression Is Associated with Defective Insulin Secretion in Humans and Mice. Am J Hum Genet 100, 238-256, doi:10.1016/j.ajhg.2017.01.011 (2017).
3.Rutter, G. A., Gresch, A., Delgadillo Silva, L. & Benninger, R. K. P. Exploring pancreatic beta-cell subgroups and their connectivity. Nat Metab 6, 2039-2053, doi:10.1038/s42255-024-01097-6 (2024).
4.Johnston, N. R. et al. Beta Cell Hubs Dictate Pancreatic Islet Responses to Glucose. Cell Metab 24, 389-401, doi:10.1016/j.cmet.2016.06.020 (2016).
5.Hodson, D. J. et al. Lipotoxicity disrupts incretin-regulated human beta cell connectivity. J Clin Invest 123, 4182-4194, doi:10.1172/JCI68459 (2013).
6Hu, M. et al. Chromatin 3D interaction analysis of the STARD10 locus unveils FCHSD2 as a regulator of insulin secretion. Cell Rep 34, 108881, doi:10.1016/j.celrep.2021.108881 (2021).

