
【学术笔记】发育小鼠大脑皮层中细胞迁移的调控
记录人:涂傲洋 陈晓伟实验室
2025年08月12日下午,受北大-清华生命科学联合中心PI饶毅和北大-清华生命科学联合中心PI陈晓伟邀请,庆应义塾大学医学院解剖学系教授 Kazunori Nakajima在生命科学学院吕志和楼B101来一场题为 “Control of cell migration in the developing mouse cerebral cortex” 的精彩报告。
Kazunori Nakajima教授报告开始前的现场
大脑皮质的正常功能依赖于其高度有序的细胞架构,而这一架构的形成,关键在于发育过程中各类细胞能够从起源位置精确迁移至其功能位点。例如,新皮质的兴奋性神经元起源于脑室区(VZ)和脑室下区(SVZ),通过径向迁移沿放射状胶质纤维到达皮质板,并依据出生时间形成“由内而外”的六层结构。另一方面,皮质中间神经元则主要起源于神经节隆起,通过切线迁移长距离迁徙至皮层。神经元迁移的失败会导致皮质层结构异常及相关疾病。尽管神经元分布的机制已得到较为充分的研究,但星形胶质细胞——大脑皮层中执行代谢支持、突触形成与调控等关键功能的胶质细胞——是如何在皮质中广泛而弥散地分布的,其机制长期以来并不清楚。在发育过程中,星形胶质细胞主要是在神经发生期后由放射状胶质细胞产生的,其中原生质星形胶质细胞需要迁移至皮质板,而纤维性星形胶质细胞则主要分布于白质。Nakajima教授团队的研究正是为了揭示星形胶质细胞祖细胞完成这一复杂迁移过程的细胞行为与分子调控机制。Kazunori Nakajima教授在此次报告中分享了其团队在大脑皮质发育过程中细胞迁移调控机制方面的系列研究工作。内容重点聚焦于:Reelin信号通路在神经元径向迁移、终极转位及“由内而外”层次形成中的多重调控功能;团队最新发现的星形胶质细胞祖细胞在发育皮质中的新型迁移模式——不规则迁移(Irregular Migration) 与血管引导迁移(Vasculature-Guided Migration);探讨上述细胞迁移模式转换的潜在内在与外在调控因素,及其对理解皮质组装与相关疾病的启示。
图一,新皮质发育过程中兴奋性神经元的迁移模式图式以及控制神经元迁移的 Reelin 信号传导下游的分子机制1
核心发现:星形胶质细胞祖细胞的双阶段迁移模式
通过结合体外培养与体内时滞成像技术以及谱系追踪等方法,Nakajima团队揭示了星形胶质细胞祖细胞在发育大脑皮质中展现出一种动态的、分阶段的迁移行为。
第一阶段:不规则迁移
在迁移初期,这些祖细胞并不像神经元那样进行方向明确的移动,而是表现出一种快速、运动方向持续变化的不规则迁移模式。这种看似“漫无目的”的运动行为,有助于祖细胞在皮质组织中进行大范围的探索和扩散。
图二, 不稳定的迁移:星形胶质细胞祖细胞的特征迁移模式4
第二阶段:血管引导迁移
Nakajima团队通过构建巧妙的体内荧光报告系统,证明在经历了一段不规则迁移后,星形胶质细胞祖细胞的运动模式会发生显著转变。它们会开始沿着既有的血管系统进行迁移,血管在此过程中充当了引导其迁移路径的“轨道”或支架。这种血管引导迁移的模式,可能确保了星形胶质细胞祖细胞能够更高效、更精确地抵达目标皮质区域。
图三, 血管引导迁移:星形胶质细胞祖细胞的另一种迁移模式4
图四, 星形胶质细胞祖细胞迁移模式转变的可能机制2
迁移模式的转换机制:内在程序与外在信号的协同
这种独特的迁移模式转换背后的调控逻辑,是Nakajima团队深入探讨的核心科学问题:这究竟是一个由细胞内在程序主导的过程,还是由外部环境信号驱动的结果?他们认为,答案很可能是两者协同作用的结果。
外在信号因素:血管内皮细胞可能分泌特定的趋化因子或生长因子,化学吸引星形胶质细胞祖细胞。同时,血管周围的细胞外基质的物理化学性质也可能为祖细胞的粘附和迁移提供适宜的微环境。
内在程序因素:祖细胞自身可能预存了一个发育时间表,在特定的时间点启动与血管识别和相互作用的基因程序。
亟待探索的分子基础:团队目前正致力于鉴定介导星形胶质细胞祖细胞与血管相互作用的关键分子。这些分子(例如特定的细胞粘附分子或受体-配体对)的发现,将是彻底阐明迁移模式转换机制的核心。
研究的深化与关联:Reelin信号的启示
Nakajima团队对大脑皮质细胞迁移调控的理解并非孤立于星形胶质细胞。他们在神经元迁移领域,特别是对Reelin信号通路的长期研究,为理解细胞空间排列的普遍原则提供了宝贵见解。Reelin作为一种关键的细胞外蛋白,传统上被认为是神经元迁移的“停止信号”。然而,团队的研究发现,异位表达Reelin可以在皮质中间层诱导形成具有“由内而外”层次结构的神经元聚集体,这表明Reelin的功能远不止于让细胞停止,更是神经元空间排列的主动组织者。近期研究进一步揭示,Reelin可通过Rap1–N-cadherin通路短暂增强神经元间的黏附,从而促进聚集体的形成。这些关于神经元迁移和定位的精细调控机制,为理解星形胶质细胞如何最终在皮质中分布提供了重要的参考和对比框架。
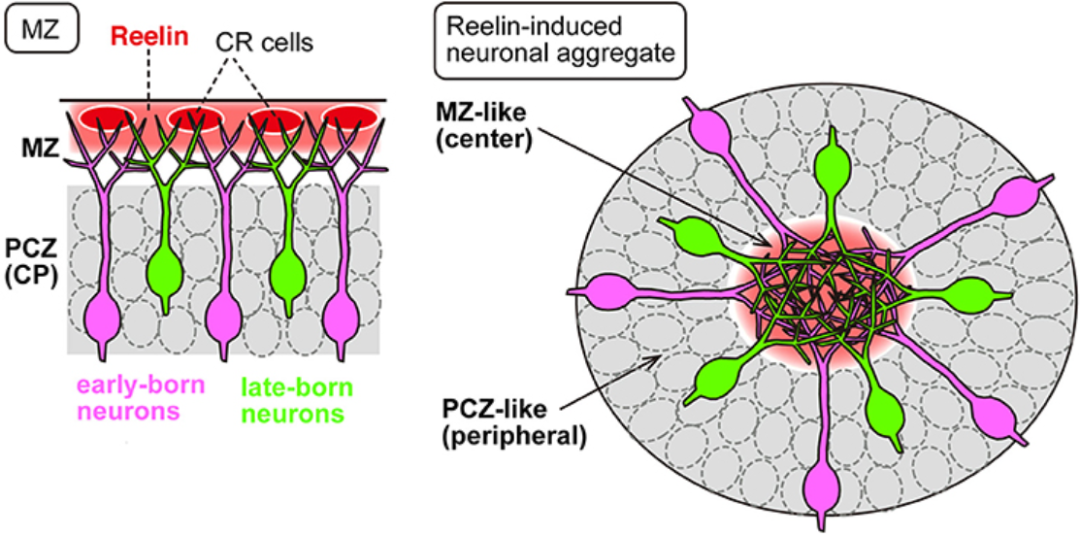
图五, Reelin 的异位表达引起体内神经元聚集1
研究意义与未来展望
Nakajima团队的这项工作,不仅揭示了一种此前未被充分认识的胶质细胞发育模式——“不规则迁移”向“血管引导迁移”的转换,更重要的是,它提出了关于大脑皮质中不同细胞类型(神经元与胶质细胞)如何通过截然不同的迁移策略最终实现精确空间组装的全新视角。
这一发现具有重要的潜在临床与转化意义。星形胶质细胞是正常大脑功能的关键支持者,其功能障碍与多种精神疾病有关。由于星形胶质细胞祖细胞在血管引导下迁移的缺陷可能导致星形胶质细胞在皮层中的定位缺陷,因此,阐明星形胶质细胞祖细胞迁移模式转换的机制,可能为理解此类精神疾病的病理生理学并提供新的干预思路。
未来的研究方向将聚焦于:
参考文献
1.Hirota, Yuki, and Kazunori Nakajima. “Control of Neuronal Migration and Aggregation by Reelin Signaling in the Developing Cerebral Cortex.” Frontiers in cell and developmental biology vol. 5 40. 26 Apr. 2017, doi:10.3389/fcell.2017.00040
2. Miyajima, Michio et al. “Migratory mode transition of astrocyte progenitors in the cerebral cortex: an intrinsic or extrinsic cell process?.” Neural regeneration research vol. 19,3 (2024): 471-472. doi:10.4103/1673-5374.380886
3.Riva, Martina et al. “De novo monoallelic Reelin missense variants cause dominant neuronal migration disorders via a dominant-negative mechanism.” The Journal of clinical investigation vol. 134,16 e153097. 9 Jul. 2024, doi:10.1172/JCI153097
4.Tabata, Hidenori et al. “Erratic and blood vessel-guided migration of astrocyte progenitors in the cerebral cortex.” Nature communications vol. 13,1 6571. 2 Nov. 2022, doi:10.1038/s41467-022-34184-x
