【学术笔记】对HIV-1衣壳的研究之旅:从组装到入核
记录人:杨钧瀚 郭强实验室
2024年12月12日下午,受北大-清华生命科学联合中心郭强研究员邀请,来自牛津大学的章佩君教授在北京大学生命科学学院邓祐才报告厅带来一场题为“The Journey of the HIV-1 Capsid: From Assembly to Nuclear Entry”的报告。
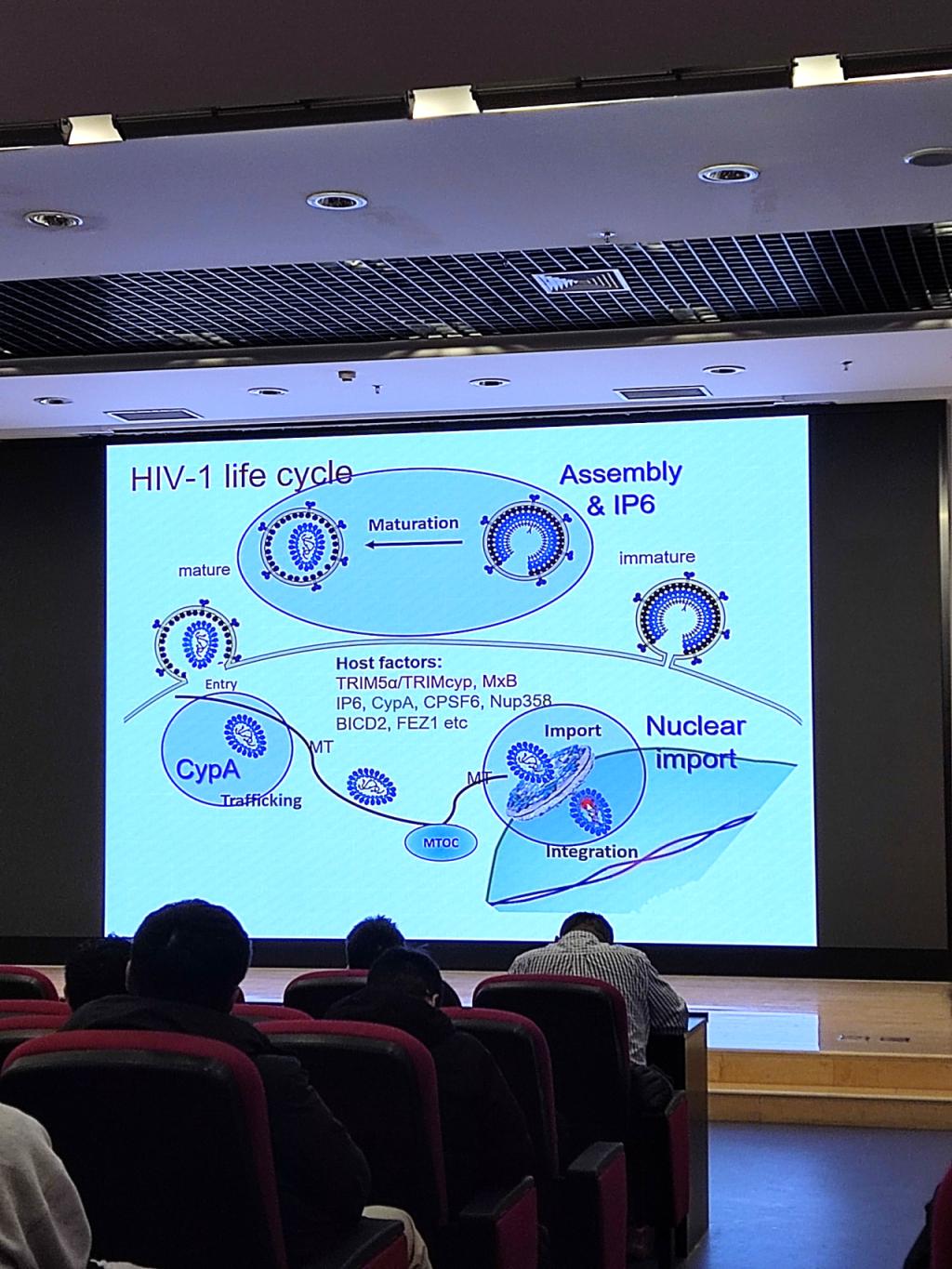
包括人类免疫缺陷病毒 1(HIV-1)在内的逆转录病毒含有衣壳,衣壳包裹着病毒的 RNA 基因组、酶和附属蛋白。衣壳的组装、成熟和稳定是病毒复制周期中必不可少的步骤。此外,衣壳表面还是病毒与宿主细胞相互作用的关键界面,它介导病毒与宿主防御蛋白和病毒依赖因子的接触。衣壳已成为抗病毒药物开发的核心靶点,最近推出的长效衣壳靶向药物lenacapavir就是一例。章佩君教授首先介绍了HIV-1衣壳的组装及其与宿主因子(包括lP6和cyclophilin A)的相互作用,重点介绍了对这些宿主因子稳定HIV-1衣壳至关重要的新型相互作用。此外,章佩君教授还讨论了她们最近对完整 HIV-1 衣壳的入核和 T 细胞中染色质纤维结构的原位研究。
IP6在HIV-1衣壳组装和成熟过程中的作用
第一部分,章佩君老师介绍了团队在HIV-1衣壳的组装和成熟上的研究。IP6在HIV-1病毒的未成熟和成熟衣壳中都扮演着重要角色,尽管其作用机制不同。在未成熟的Gag蛋白中,IP6被两个由赖氨酸残基K158和K227组成的环所包裹,这些环位于由CA蛋白C端和空间肽1构成的六螺旋束的起始部分,有助于稳定未成熟的Gag晶格。在成熟的衣壳中,IP6由六聚体和五聚体中心腔中的R18环所协调。团队采用了一种名为perfringolysin O(PFO)的蛋白质来穿透HIV-1病毒颗粒的膜,这样做可以让宿主蛋白和小分子接触到病毒衣壳的天然状态,并且提高了冷冻电镜图像的质量。
随后他们使用了冷冻电子断层扫描(cryo-ET)和子断层平均技术来确定在有无肌醇六磷酸(inositol hexakisphosphate, IP6)和环孢素A(cyclophilin A)存在的情况下,天然衣壳蛋白(capsomers)的结构。基于这些结构数据,他们构建了一个完整的HIV-1病毒衣壳的全原子模型。揭示了两个IP6结合位点以及环孢素A的相互作用模式。自由能计算支持了在R18和K25位置的两个结合位点,并进一步显示了IP6通过五聚体时存在的能量障碍1。
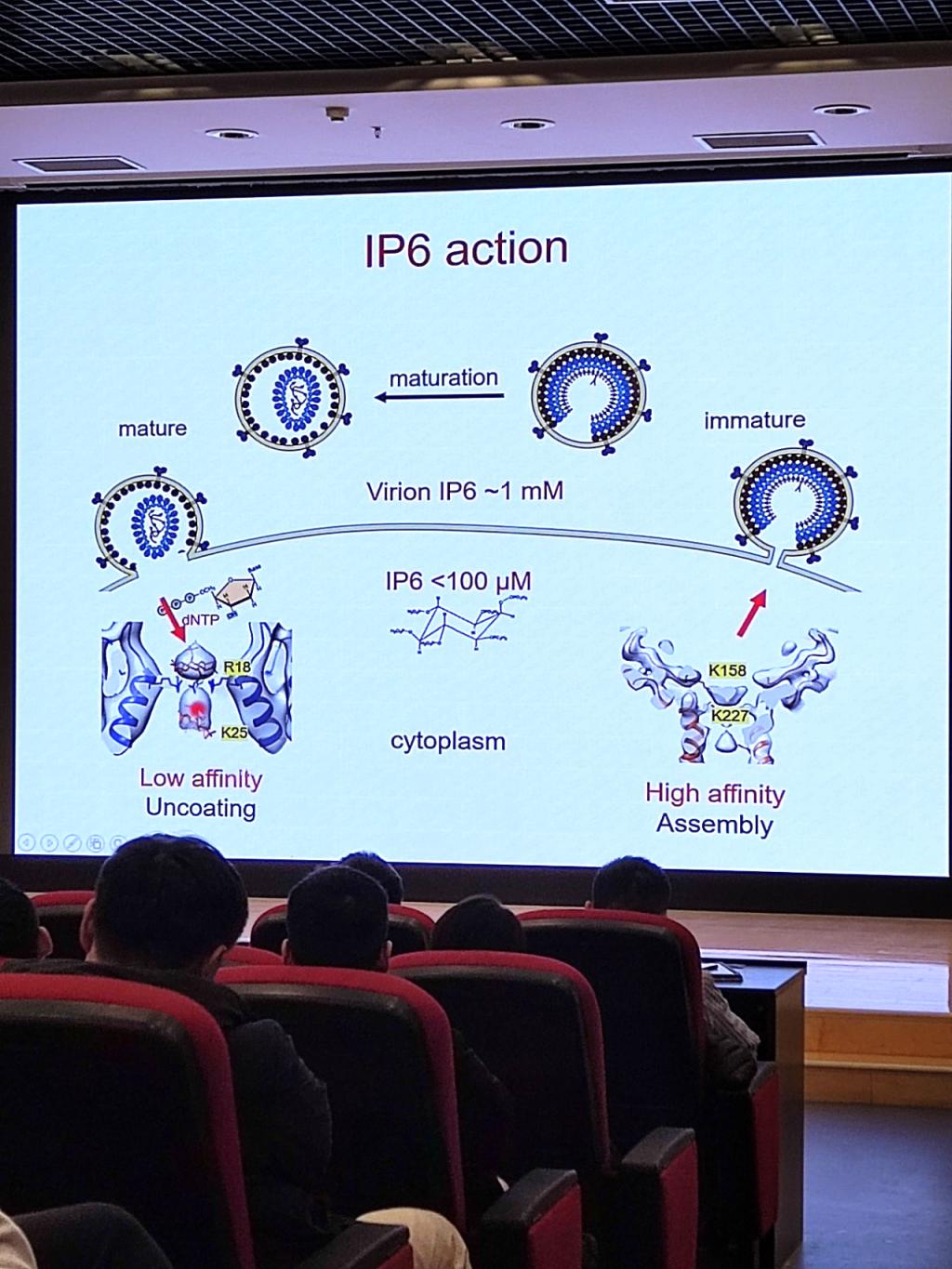
图二:IP6在HIV-1衣壳组装和成熟过程中的作用
cyclophilin A(CypA)通过新型相互作用稳定HIV-1衣壳
随后,章佩君老师分享了团队关于CypA的相关研究。CypA是宿主细胞中的一种因子,它可以直接与HIV-1的衣壳(capsid)相互作用,并调节病毒的感染性。尽管CypA与HIV-1衣壳蛋白(CA)的N端结构域复合物的晶体结构已经被知晓,但CypA如何与病毒衣壳相互作用以及如何调节HIV-1感染性的具体机制仍然不清楚。
章佩君团队确定了CypA与组装好的HIV-1衣壳复合物的冷冻电镜(Cryo-EM)结构。这个结构揭示了CypA的一个独特的结合模式,其中CypA选择性地连接两个沿着最高曲率方向的CA六聚体。通过电子显微镜引导的全原子分子动力学模拟和固态核磁共振(NMR)进一步揭示了CypA结合模式的实现方式。即单个CypA分子同时与两个不同六聚体中的两个CA亚基通过一个以前未被描述的非典型界面相互作用。通过确定来自不同螺旋对称性的多种结构,研究进一步揭示了CA分子的基本可塑性,这种可塑性允许形成连续弯曲的圆锥形衣壳,以及CypA感知衣壳模式的机制。这些结果为CypA如何稳定HIV-1衣壳以及如何被招募来促进HIV-1感染提供了新的见解2,3。

图三:CypA在稳定HIV-1衣壳时的新型作用方式
T细胞中染色质纤维的原位结构
第二部分,章佩君老师分享了团队在T细胞染色质纤维上的原位结构研究。并调侃道这其实是他们研究HIV-1过程中的额外收获。为了得到HIV-1入核的断层图像,却顺便观察到了细胞核内染色质的结构。
染色质是细胞核中DNA和组蛋白的复合物,它在调控基因转录(基因的活动状态)、DNA复制和修复(修复DNA损伤)、以及染色体分离(在细胞分裂时确保每个新细胞获得一套完整的染色体)中扮演着关键角色。尽管染色质的功能非常重要,但其精确的三维结构尚未完全明了。此外目前染色质组装形成的30 nm纤维的结构也尚未观测到。
章佩君团队使用了冷冻电子断层扫描(cryo-ET)技术描绘了人类T淋巴细胞在细胞间期中的天然染色质纤维的三维结构,并确定了不同构象下核小体(染色质的基本结构单元)的原位结构。
研究发现,染色质纤维并不是由均匀的30纳米直径的单起点或双起点丝状结构组成,而是由放松的、可变的之字形排列的核小体通过直线连接的DNA连接而成。此外,那些含有较少H1(一种组蛋白)和连接DNA密度的核小体呈现随机分布,没有任何空间偏好4。
图四:T细胞中染色质纤维的原位结构
HIV-1衣壳入核的不同阶段
第三部分,章佩君老师分享了团队使用Cryo-ET技术观测到了HIV-1衣壳入核的不同阶段的研究成果。在最开始,团队只能从大量断层图像中捕获到极少(1%)的处于入核阶段的衣壳。为了提高捕获入核阶段的成功率,团队使用了Cryo-CLEM技术。通过荧光标记细胞核和HIV-1衣壳,他们实现了对入核阶段的光电联合定位,从而大大提高了成功率。
结合这些断层图像数据,团队成功观测到了HIV-1衣壳入核的多个阶段。他们将其分为cytoplasmic,approaching,docking,passing-through,imported五个阶段。此外他们还分析了多大的衣壳可以更方便地入核,以及核孔复合物在衣壳入核前中后的变化等。目前尚未发表。
参考文献
1. Tao Ni et al., Structure of native HIV-1 cores and their interactions with IP6 and CypA. Sci. Adv. 7, eabj5715 (2021).
2. Liu, C., Perilla, J., Ning, J. et al. Cyclophilin A stabilizes the HIV-1 capsid through a novel non-canonical binding site. Nat Commun 7, 10714 (2016).
3. Ni, T., Gerard, S., Zhao, G. et al. Intrinsic curvature of the HIV-1 CA hexamer underlies capsid topology and interaction with cyclophilin A. Nat Struct Mol Biol 27, 855–862 (2020).
4. Hou, Z., Nightingale, F., Zhu, Y. et al. Structure of native chromatin fibres revealed by Cryo-ET in situ. Nat Commun 14, 6324 (2023).
