生命中心葛亮团队揭示非经典分泌蛋白进入膜泡的分子机制
蛋白质分泌是细胞之间进行信息传递的核心方式之一。我们通常所指的分泌蛋白具有N端的信号肽序列,能够被信号识别颗粒(SRP)所识别并通过SEC61转运体(translocon)进入内质网腔,随后信号肽被切除,分泌蛋白经过加工和修饰,通过内质网-高尔基体(ER-Golgi)膜泡运输途径被运送到细胞外,该过程被称为经典分泌途径【1-3】,其关键内容已经被写入细胞生物学教科书。 近年来研究发现,许多蛋白质的分泌不依赖于ER-Golgi的常规分泌途径,称为非经典分泌(Unconventional Protein Secretion, UPS)【4,5】。大多数UPS蛋白不具有典型的信号肽,其分泌主要通过两种方式:(1)直接穿越细胞质膜(I型)【6,7】; (2)类似于经典分泌,需要膜泡运输介导(III型)【8,9】。在III型UPS中,蛋白质需要进入一个膜泡载体(例如分泌性自噬体和溶酶体等),然后通过膜泡运输系统被运送到细胞外。由于缺少信号肽的导向,一个亟待解决的关键问题就是这类UPS货物是如何进入膜泡载体中的。 2020年4月8日,生命中心葛亮课题组在Cell杂志在线发表题为“A translocation pathway for vesicle -mediated unconventional protein secretion”的研究论文,报道了一条介导UPS货物进入膜泡的蛋白跨膜转运分子通路。

促炎症因子IL-1β (interleukin-1β)是第一个被发现,同时也是研究最多的非经典分泌蛋白【10】。IL-1β可通过I型和III型UPS分泌:I型途径中,IL-1β主要通过Gasdermin D(GSDMD)N末端片段在细胞质膜上形成的孔被释放【11-13】;III型途径中,成熟型IL-1β (mIL-1β)被会运送到一个膜泡载体中【14-18】。在之前的研究工作中,作者建立了一套分析mIL-1β分泌的细胞学系统,发现mIL-1β能够转运进一个中间膜泡结构并进入自噬体的双层膜结构之间,最终通过分泌型自噬被分泌到胞外,并且这一跨膜转运过程依赖于蛋白质的去折叠【17】,这预示着存在一个类似translocon的膜通道(图1)。
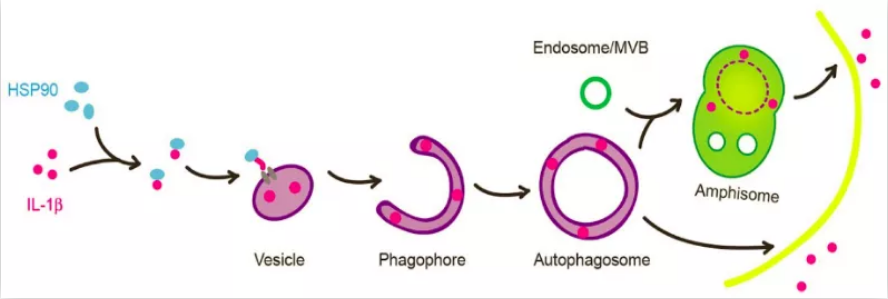
图1. IL-1β进入膜泡载体并通过分泌型自噬被分泌
该工作中作者为鉴定这个未知的通道蛋白,采用二氢叶酸还原酶(DHFR)系统,并结合了蛋白质交联和质谱技术。由于氨基蝶呤(aminopterin)抑制DHFR的去折叠,折叠形式的DHFR会像塞子一样将mIL-1β-flag-DHFR阻滞在膜转运机器上。之后通过化学交联与免疫沉淀富集转运机器并通过质谱进行鉴定,找到了一个膜蛋白TMED10(图2)。细胞学研究发现TMED10调控mIL-1β的分泌。在CLP诱导的败血性休克(Cecal Ligation and Puncture (CLP)-induced septic shock)小鼠模型中,TMED10髓系敲除的小鼠分泌更少的mIL-1β, 进而导致更低的炎症反应与更高的存活率,提示TMED10在某些生理条件下调控炎症因子的释放和炎症反应。
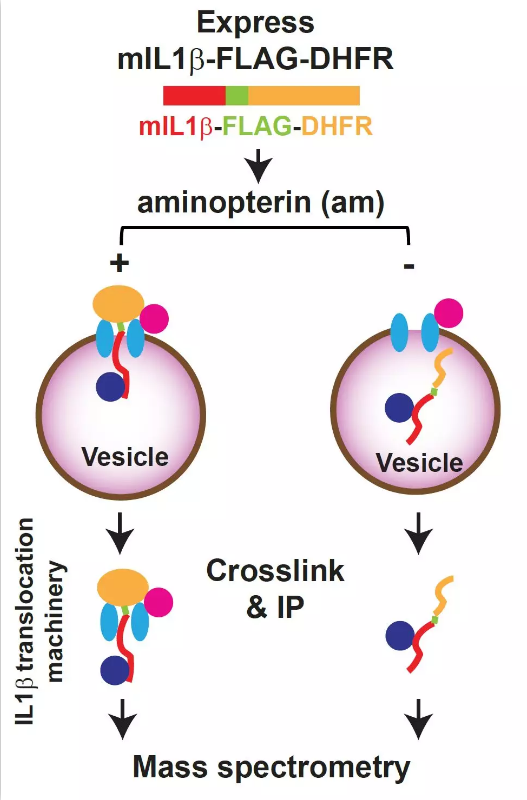
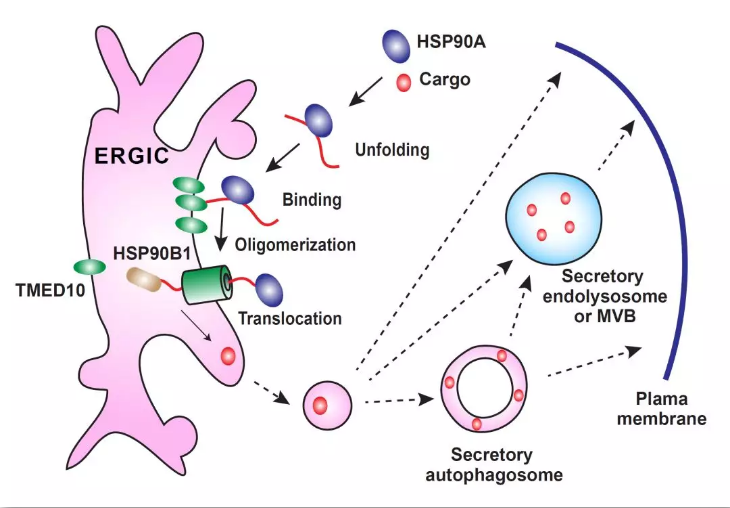
图3. TMED10介导的蛋白质非经典分泌途径工作模型
参考文献:
1.S. O. Shan, P. Walter, Co-translational protein targeting by the signal recognition particle. FEBS Lett 579, 921-926 (2005).
2.G. Zanetti, K. B. Pahuja, S. Studer, S. Shim, R. Schekman, COPII and the regulation of protein sorting in mammals. Nat Cell Biol 14, 20-28 (2011).
3.T. A. Rapoport, L. Li, E. Park, Structural and Mechanistic Insights into Protein Translocation. Annu Rev Cell Dev Biol 33, 369-390 (2017).
4.W. Nickel, C. Rabouille, Mechanisms of regulated unconventional protein secretion. Nat Rev Mol Cell Biol 10, 148-155 (2009).
5.C. Rabouille, V. Malhotra, W. Nickel, Diversity in unconventional protein secretion. J Cell Sci 125, 5251-5255 (2012).
6.J. P. Steringer, W. Nickel, A direct gateway into the extracellular space: Unconventional secretion of FGF2 through self-sustained plasma membrane pores. Semin Cell Dev Biol 83, 3-7 (2018).
7.T. Schafer et al., Unconventional secretion of fibroblast growth factor 2 is mediated by direct translocation across the plasma membrane of mammalian cells. J Biol Chem 279, 6244-6251 (2004).
8.V. Malhotra, Unconventional protein secretion: an evolving mechanism. EMBO J 32, 1660-1664 (2013).
9.J. M. Duran, C. Anjard, C. Stefan, W. F. Loomis, V. Malhotra, Unconventional secretion of Acb1 is mediated by autophagosomes. J Cell Biol 188, 527-536 (2010).
10.A. Rubartelli, F. Cozzolino, M. Talio, R. Sitia, A novel secretory pathway for interleukin-1 beta, a protein lacking a signal sequence. EMBO J 9, 1503-1510 (1990).
11.N. Kayagaki et al., Caspase-11 cleaves gasdermin D for non-canonical inflammasome signalling. Nature 526, 666-671 (2015).
12.J. Shi et al., Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature 526, 660-665 (2015).
13.C. L. Evavold et al., The Pore-Forming Protein Gasdermin D Regulates Interleukin-1 Secretion from Living Macrophages. Immunity 48, 35-44 e36 (2018).
14.G. Schatz, B. Dobberstein, Common principles of protein translocation across membranes. Science 271, 1519-1526 (1996).
15.P. A. Verhoef, M. Estacion, W. Schilling, G. R. Dubyak, P2X7 receptor-dependent blebbing and the activation of Rho-effector kinases, caspases, and IL-1 beta release. J Immunol 170, 5728-5738 (2003).
16.N. Dupont et al., Autophagy-based unconventional secretory pathway for extracellular delivery of IL-1beta. EMBO J 30, 4701-4711 (2011).
17.M. Zhang, S. J. Kenny, L. Ge, K. Xu, R. Schekman, Translocation of interleukin-1beta into a vesicle intermediate in autophagy-mediated secretion. Elife 4, (2015).
18.C. Semino, S. Carta, M. Gattorno, R. Sitia, A. Rubartelli, Progressive waves of IL-1beta release by primary human monocytes via sequential activation of vesicular and gasdermin D-mediated secretory pathways. Cell death & disease 9, 1088 (2018).
19.L. Ge, D. Melville, M. Zhang, R. Schekman, The ER-Golgi intermediate compartment is a key membrane source for the LC3 lipidation step of autophagosome biogenesis. Elife 2, e00947 (2013).



